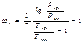Поведение газов описывается уравнением состояния, к-е связывает между собой Р, V, Т и массу (кол-во молекул газа). Для идеальных газов известно следующее ур-е состояния Клапейрона – Менделеева PV=MRT, где R-универсальная газовая постоянная, кДж/(кг*К), как показали многочисленные исследования, поведение реальных природных газов может значительно отличаться от уровнения Кл.-Мен.. Для описания поведения реальных газов в последнее вводят корректирующий множитель, называемый коэффициентом сверхсжимаемости z: PV=zMRT. Обычно z определяется экспериментально как функция Р, Т и состава газа. Д.Браун и Д.Катц на основании изучения результатов своих экспериментальных измерений z установили, что если приведённые параметры различных природных газов одинаковы (Рпр, Тпр), то они находятся в соответственных состояниях, при которых их физические и термодинамические св-ва (z, плотность и др.) одинаковы, т.е. z=z(Тпр,Рпр). Приведёнными параметрами компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (Р,Т,V,r,z) больше или меньше критических: Рпр=Р/Ркр, Тпр=Т/Ткр, Vпр=V/Vкр, rпр=r/rкр, zпр=z/zкр. Реальные природные газы - физические смеси большого числа углеводородных и неуглеводородных компонентов, простых и сложных газов. Молекулы простых газов(метан, гелий, аргон, криптон, ксенон) имеют сферическую форму, а молекулы сложных газов и жидкостей- несферическую. Для простых газов силы притяжения, действующие вдоль линии, соединяющей центры сферических молекул, пропорциональны расстоянию в шестой степени. Для сложных газов и жидкостей силы притяжения (или отталкивания) между различными группами молекул пар не м/б представлены лишь одной силой притяжения между центрами молекул. Для учета других нецентричных сил вводится ацентричный фактор w. Он является третьим после Рпр,Тпр параметром, оценивающим z: z=z(Тпр,Рпр, w). Z можно определить графически, зная Рпр.см,Тпр.см. Приведённые параметры для смесей газов: Рпр.см=Р/Ркр.см, Тпр.см=Т/Ткр.см, Vпр.см=V/Vкр.см, rпр.см=r/rкр.см, zпр.см=z/zкр.см, где псевдокритические (среднекритические) параметры смеси: Ркр.см.=SyiPкр.i; так же для T, V, r, z,
где yi –молярная доля компонента i в смеси газов; Pкр.i ….zкр.i-критические давление,…….; n – число компонентов в смеси.
Для определения коэфф-та z уравнение Редлиха-Квонга преобразуется к виду
z3- z2+ z(a2- b2P-b)P- a2bP2=0, где
a2=0,4278Ткр2,5/РкрТ2,5
b=0,0867Ткр/РкрТ
Сила притяжения действует по линии, соединяющей центры этих сферических молекул. Форма сложно построенных очень далека от сферический поэтому силы взаимодействия(притяжения или отталкивания) уже нельзя представить действительно лишь вдоль одной линии, соединяющий центры сфер, это взаимодействие является сложным, как раз для учета нецентрических сил вводим ω.
Z=(Рпр.,Тпр.,ω)
Zсм=z0(Рпр.см;Тпр.см)+z1=(Рпр.,Тпр)ωсм
где z0-коэф. сверхсжимаемости для простых одноатомных газов. z1-поправка к обобщенному коэф. сверхсжимаемости для сложных многоатомных газов и жидкостей.
ωсм= 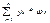 ωi-находится по таблице Кэя. или Эдмистера
ωi-находится по таблице Кэя. или Эдмистера