Мета роботи: Визначити відношення молярних теплоємностей повітря методом адіабатичного розширення
Обладнання Установка для визначення коефіцієнта Пуассона газу методом адіабатичного розширення 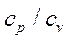
І. ТЕОРЕТИЧНІ ДАНІ
Властивості реальних газів, в тому числі повітря, при невеликому тиску і не дуже низьких температурах, близькі до ідеального газу.
З точки зору молекулярно - кінетичної теорії ідеальним газом називається газ, що складається з молекул, які можна вважати матеріальними точками, потенціальною енергією взаємодії таких молекул можна знехтувати і взаємодію молекул можна розглядати як зіткнення пружних куль.
Ідеального газу в природі не існує. Існують тільки реальні гази. Реальний газ можна вважати ідеальним при низьких тисках і невеликих температурах.
Стан ідеального газу описується рівнянням Менделєєва-Клапейрона
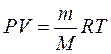 , (1)
, (1)
де Р – тиск газу, V – його об'єм, Т – температура газу, m – маса газу, М – молярна маса, яка дорівнює масі одного моля речовини і в СІ вимірюється у кілограмах на моль у мінус першому степені.
Об'єм одного моля ідеального газу при норм, умовах (р = 760 мм рт. ст. = 101,325 кПа, t=0°С) дорівнює 0,0224м3 /Моль; R = 8,314510 Дж/(моль К). R – універсальна газова стала.
Фізичний зміст універсальної газової сталої: універсальна газова стала R чисельно дорівнює роботі розширення 1 моля ідеального газу при ізобарному нагріванні його на 1К.
Процес, що відбувається при сталій величині одного з параметрів газу називають ізопроцесом.
Процес, що відбувається при постійному тиску називають ізобарним (Закон Гей- Люссака)
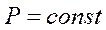 ,
, 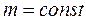 ,
, 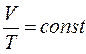 (2)
(2)
Процес, що відбувається при постійному об'ємі – ізохорним (Закон Шарля)
 ,
, 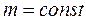 ,
, 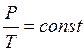 (3)
(3)
Процес, що відбувається при постійній температурі називається ізотермічним і описується рівнянням Бойля – Маріотта.
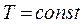 ,
, 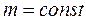 ,
, 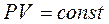 (4)
(4)
Процес, що відбувається без теплообміну між газом і навколишнім середовищем, називається адіабатичним і описується рівнянням Пуассона
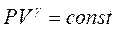 , (5)
, (5)
де постійна для кожного стану газу величина 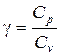 , коефіцієнт Пуассона, є відношення молярної теплоємності газу при ізобарному процесі, до молярної теплоємності газу при ізохорному процесі.
, коефіцієнт Пуассона, є відношення молярної теплоємності газу при ізобарному процесі, до молярної теплоємності газу при ізохорному процесі.
Молярна теплоємність газу вимірюється кількістю теплоти, що необхідна для нагрівання одного моля газу на один Кельвін і залежить від умов нагрівання.
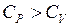 тому, що кількість тепла яка надається при ізобарному процесі іде не тільки на збільшення внутрішньої енергії газу, а і на виконання роботи проти зовнішніх сил в процесі розширення. При цьому
тому, що кількість тепла яка надається при ізобарному процесі іде не тільки на збільшення внутрішньої енергії газу, а і на виконання роботи проти зовнішніх сил в процесі розширення. При цьому
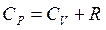 , (6)
, (6)
де R – універсальна газова стала.
Цей вираз називають формулою Майєра.
З молекулярно – кінетичної теорії відома формула для визначення 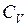 і
і 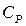 для ідеального газу.
для ідеального газу.
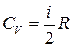 ,
, 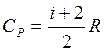 , (7)
, (7)
де і – число ступенів вільності молекули ідеального газу.
Числом ступенів вільності молекули є число мінімальної кількості координат, що повністю визначають положення молекули в просторі.
Для одноатомного газу і = 3; для двохатомного і = 5; для трьохатомного і багатоатомного і =6.
Якщо відомо відношення  , то необхідність в експериментальному визначенні
, то необхідність в експериментальному визначенні 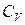 відпадає і тоді
відпадає і тоді  знаходиться по формулі 7.
знаходиться по формулі 7.
В даній лабораторній роботі визначається коефіцієнт Пуассона 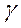 для повітря.
для повітря.
Фізичний зміст методу адіабатного розширення полягає в тому, що при адіабатному розширенні зменшення тиску зумовлене не тільки збільшенням його об’єму, а й зменшенням температури.






