Титрование – метод количественного анализа для определения концентрации известного вещества А, находящегося в смеси с другими компонентами. Для титрования подбирают специальный реагент B, называемый титрантом, который избирательно реагирует с определяемым компонентом А по схеме (см. рис.11,а):
А + B = M + N, (52)
где M, N – продукты титрования.
Пример титрования:
HCl + KOH = KCl + H2O
(A) + (B) = (M) + (N)
Титрующее вещество B добавляют до тех пор, пока не прореагирует все количество определяемого вещества А, содержащегося в пробе. При этом количество QB титранта B эквивалентно количеству QA титруемого вешества А:
QA = kP* QA, (53)
где kP - стехиометрический коэффициент реакции титрования.
Количество титруемого вещества:
QA = CA * QПР, (54)
где CA - концентрация вещества А в анализируемой пробе; QПP =const -
- количество исходной пробы.
Эквивалентное количество титранта:
QB = CB * VB, (55)
где CB - концентрация титранта; VB - эквивалентный объем титранта.
Отсюда получаем зависимость искомой концентрации CA от эквивалентного объема VB титранта:
CA = kT * VB, (56)
-28 –
где kT = kP * CB/QПР=const.
Следовательно, мерой концентрации CA определяемого компонента А
является эквивалентный объем VB титранта В.
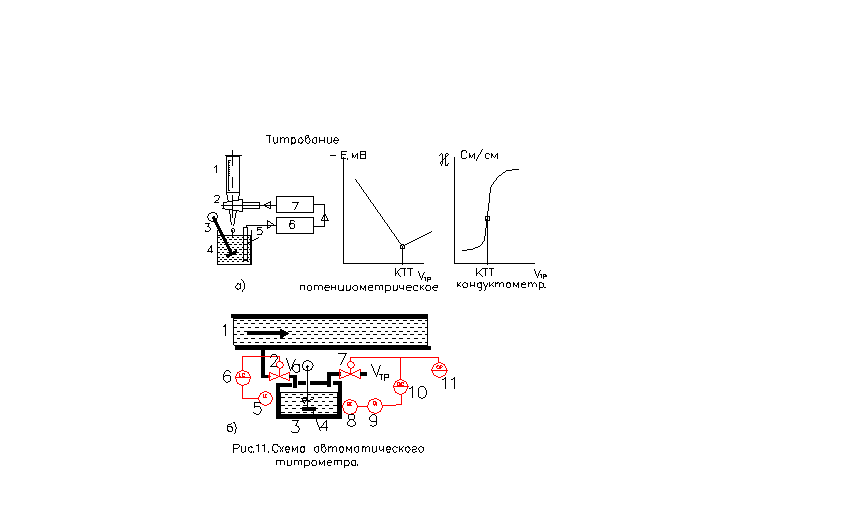
Момент эквивалентности, когда определяемое вещество А полностью прореагировало с титрантом В, называется конечной точкой титрования (КТТ). В этот момент в пробе присутствуют только продукты титрования M, N. Для определения КТТ (см. рис.11,а) применяют различные методы: потенциометрический (по рН раствора), кондуктометрический (по электропроводности χ раствора) и т.п. В момент КТТ происходит резкое изменение измеряемого свойства раствора.
- 29 -
Схема автоматического объемного титрометра, - см. рис. 11,б.






