Раствор дитизона в хлороформе или четырёххлористом углероде образует с Zn2+ в щелочной среде внутрикомплексную соль,окрашенную в малиново- красный цвет. В отличие от дитизонатов других элементов эта соль окрашивает в щелочной среде не только слой CHCl3, но и водный слой. В кислых растворах дитизонат цинка растворим. Дитизон или дифенилтиокарбазон имеет следующий состав и строение:
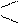 SC SC 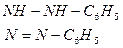
|
Цинк проявляет координационное число, равное четырём:
 C6H5 –– NH – N –– Zn –– N – NH –– C6H5
С=S S =С
C6H5 –– N = N N = N –– C6H5 C6H5 –– NH – N –– Zn –– N – NH –– C6H5
С=S S =С
C6H5 –– N = N N = N –– C6H5
|
Предел обнаружения – 1 мкг. Мешают Ag(I), Bi(III), все катионы VI группы. Их маскируют тиосульфатом, цианидом, либо осаждают в виде сульфидов.
В ы п о л н е н и е р е а к ц и и. Реакцию удобно проводить следующим образом: на полоску фильтровальной бумаги нанести каплю соли цинка, 2-3 капли раствора NaOH. Затем влажное пятно обвести по периферии капилляром с раствором дитизона. Отметить цвет кольца, характерный для Zn2+ . Если ионы Zn2+ отсутствуют, образуется кольцо оранжевого цвета, характерное для дитизона в щелочной среде. Параллельно провести холостой опыт: нанести рядом 2 капли раствора NaOH и подействовать каплей дитизона.






