а) Окисление в щелочной среде. При действии H  O
O  в щелочной среде и нагревании происходит изменение окраски соли хрома в жёлтую за счет окисления Cr
в щелочной среде и нагревании происходит изменение окраски соли хрома в жёлтую за счет окисления Cr 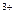 в CrO
в CrO 
 :
:
Cr 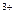 + 4OH
+ 4OH  = [Cr (OH)
= [Cr (OH)  ]
] 
2[Cr (OH)  ]
]  + 3H
+ 3H  O
O  + 2OH
+ 2OH  = 2CrO
= 2CrO 
 + 8 H
+ 8 H  O
O
[Cr (OH)  ]
]  + 4OH
+ 4OH  = CrO
= CrO 
 + 4H
+ 4H  O + 3 е¯ H
O + 3 е¯ H  O
O  + 2
+ 2  = 2OH
= 2OH 
В ы п о л н е н и е р е а к ц и и. К 3-4 каплям раствора соли хрома (III) прибавить 8-10 капель раствора NaOH до образования гидроксохромита, 3-4 капли 5% Н  О
О  и нагреть в течение нескольких минут. Какие внешние изменения наблюдаются? Записать уравнения реакций, объяснить направленность второй реакции. Раствор сохранить для выполнения п. в)
и нагреть в течение нескольких минут. Какие внешние изменения наблюдаются? Записать уравнения реакций, объяснить направленность второй реакции. Раствор сохранить для выполнения п. в)
б) Окисление в кислой среде. Проводится действием более сильных окислителей, таких как KMnO  , (NH
, (NH  )S
)S  O
O  . Окисление сопровождается образованием дихромат -
. Окисление сопровождается образованием дихромат -
иона оранжевого цвета по уравнению:
2Сr 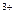 + 3S
+ 3S  O
O 
 + 7H
+ 7H  O = Cr
O = Cr  O
O 
 + 6SO
+ 6SO 
 + 14H
+ 14H 
2Cr 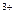 + 2MnO
+ 2MnO 

 + 5H
+ 5H  O = 2 MnO(OH)
O = 2 MnO(OH)  ↓+ Cr
↓+ Cr  O
O 
 + 6H
+ 6H 
В реакции с персульфатом аммония катализатором являются катионы Ag  .
.
В ы п о л н е н и е р е а к ц и и. В пробирку с 5-6 каплями персульфата аммония добавить по 1 капле 2N H  SO
SO  и AgNO
и AgNO  . В полученную окислительную смесь ввести 2-3 капли раствора нитрата или сульфата хрома (III). Нельзя брать CrCl
. В полученную окислительную смесь ввести 2-3 капли раствора нитрата или сульфата хрома (III). Нельзя брать CrCl  , так как может идти окисление Cl
, так как может идти окисление Cl  в Cl
в Cl  .Нагреть смесь. Наблюдать изменение окраски раствора. Раствор сохранить для п.в). Написать уравнения реакций окисления Cr
.Нагреть смесь. Наблюдать изменение окраски раствора. Раствор сохранить для п.в). Написать уравнения реакций окисления Cr 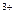 в щелочной и кислой средах, разобрать окислительно-восстановительные процессы, пользуясь ионно-электронным методом.
в щелочной и кислой средах, разобрать окислительно-восстановительные процессы, пользуясь ионно-электронным методом.
в) Получение надхромовой кислоты (H  Cr O
Cr O  ).
).
При действии на подкисленный раствор хромата или дихромата H  O
O  образуется надхромовая кислота, вследствие чего раствор окрашивается в интенсивно-синий цвет:
образуется надхромовая кислота, вследствие чего раствор окрашивается в интенсивно-синий цвет:
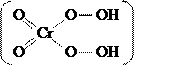 |
Cr  O
O 
 + 4H
+ 4H  O
O  + 2H
+ 2H  = 2H
= 2H  CrO
CrO  + 3H
+ 3H  O
O
В водных растворах пероксидные соединения хрома неустойчивы, происходит их разложение с образованием Cr 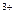 . Они устойчивы в органических растворителях (диэтиловом эфире, амиловом спирте и других).
. Они устойчивы в органических растворителях (диэтиловом эфире, амиловом спирте и других).
В ы п о л н е н и е р е а к ц и и. Составить в двух пробирках смесь из равных объёмов перекиси водорода, 2N серной кислоты и эфира. Прибавить в одну пробирку несколько капель полученного раствора CrO 
 в другую - Cr
в другую - Cr  O
O 
 . Наблюдать окрашивание эфирного слоя в синий цвет.
. Наблюдать окрашивание эфирного слоя в синий цвет.




