Состав раствора выражают в виде концентрации или доли каждого из веществ. Под концентрацией принято понимать массу, объём или количество вещества в определенной массе или объёме раствора. В связи с этим различают массовую и объёмную концентрации. Доля, показывает, какую часть от общей массы, объёма или числа молей всех компонентов раствора составляет интересующий компонент. Её называют массовой, объёмной или мольной.
Массовая доля (ω или С%) – отношение массы растворенного вещества к общей массе раствора:
m(Х)
ω(Х) = ------------------, где ω (Х) – массовая доля растворённого вещества Х;
m(р-ра) m(Х) – масса растворенного вещества Х;
m(р-ра) – масса раствора.
Массовую долю растворённого вещества ω(Х) обычно выражают в %; она показывает содержание массы растворённого вещества в 100 г раствора:
m(Х)
ω(Х) = ------------------ 100 %,например, массовая доля ω(NаСl) в растворе
m(р-ра) составляет 20 %.Это значит, что в 100 г
раствора содержится 20 г NаСl и 80 г
воды.
Молярная доля (a) – отношение количества растворенного вещества в растворе к общему количеству веществ этого раствора.
n(Х) n(Х)
a(Х) = ------------ или a(Х1) = ------------100 %
nобщ.nобщ
Количество растворенного вещества(n или ν):
m(Х)
n(Х) = ------------, где m(Х) – масса растворенного вещества Х1;
M(Х) M(Х) – молярная масса растворенного вещества Х1;
например, М(NаОН) = 40 г/моль; m(NаОН) = 80 г;
тогда n(NаОН) = 2 моль.
nобщ. = n(Х1) + n(Н2О),например, М(Н2О) = 18 г/моль; m(Н2О) = 72 г, тогда
n(Н2О) = 4 моль; nобщ. = 2 моль + 4 моль = 6 моль,
следовательно:
2моль
a(Х1) = ------------- = 0,333 или 33,3 %
6 моль
Моль – количество вещества, содержащее столько структурных единиц
(молекул, атомов, ионов, электронов и др.), сколько атомов в 0,012 кг изотопа углерода 12С.
Объёмная доля – отношение объёма растворенного вещества к общему объёму этого раствора, используется для характеристики газовых смесей, например воздуха.
V(Х1) V(Х1)
j(Х1) = ------------------ или j(Х1) = ------------------ 100 %
V (р-ра) V (р-ра)
В аналитической химии наряду с общими химическими понятиями широко используют ряд таких понятий, которые присущи только ей и помогают характеризовать состав раствора, К ним относятся: эквивалент, титр, титр по определяемому веществу.
Эквивалент – условная частица вещества Х, равноценная одному протону в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Понятие «эквивалент» применимо ко всем типам химических реакций и веществ, как простым, так и сложным. Чтобы показать, какая часть молекулы вещества является эквивалентом, используют понятие «фактор эквивалентности».
Фактор эквивалентности – число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Это безразмерная величина, которая рассчитывается на основании стехиометрических коэффициентов реакции, равная или меньше единицы:
¦экв.(Х) £ 1
Для кислотно-основных реакции ¦экв.(Х) вычисляют по числу замещенных атомов водорода, а для окислительно-восстановительных – по числу электронов, участвующих в реакции.
Эквивалент (Э) – 1/Zх часть частицы вещества. При Zх =1 эквивалент адекватен самой частице в целом. Число Zх называют числом эквивалента. Оно указывает на число замещенных (присоединенных) атомов водорода или число отданных (принятых) электронов.
Фактор и число эквивалентности связаны соотношением:
¦экв.(Х) =1/Zх, очевидно, что Z ³ 1
Эквивалент вещества, используя фактор эквивалентности, записывают ¦экв.(Х) или Э(Х) и при этом указывают его величину.
Пример, в реакции Na2CO3 + 2HCl = 2NaCl+H2О + СО2
молекула Na2CO3 эквивалентна двум протонам. Следовательно, 1/2 её часть, взаимодействующая с одним протоном, является эквивалентом. Поэтому число эквивалентности Z(Na2CO3) = 2; ¦(Na2CO3) = 1/2; Э(Na2CO3) = 1/2 Na2CO3. Значение Z(Х) можно определить по химической формуле вещества. Так, для кислот число эквивалента Z(Х) равно числу катионов водорода, способных замещатся катионами металла (равно основности кислоты). Для гидроксидов число эквивалента Z(Х) равно числу гидроксогрупп ОН-. Для солей число эквивалента Z(Х) равно числу катионов водорода кислоты, замещенных катионами металла или аммония.
Пример, в реакции:
10FeSO4 + 2KMn7¯O4 +8Н2SO4 = 5Fe2(SO4)3 + 2Mn2+SO4 + К2SO4 + 8Н2О
Mn7¯ + 5е¯ ® Mn2+, следовательно Z(КМnO4) = 5; ¦(KMnO4) = 1/5;
Э(KMnO4) =1/5 KMnO4
Молярная масса эквивалента вещества Х – это масса одного моля эквивалента этого вещества. Её записывают и рассчитывают следующим образом:
МЭ(Х) = ¦экв.(Х)· М (Х) = М (Х)/Zх, для ранее приведенных реакций:
105,99
МЭ(Na2CO3) = 1/2×105,99 = ----------- = 52,99 г
158,03
МЭ(KMnO4) = 1/5×158,03 = ----------- = 31,61 г
Молярная концентрация – отношение количества растворенного вещества к объёму раствора (количество молей растворенного вещества в 1 л раствора). Обычно её обозначают С(Х), а после численного значения пишут моль/л или М:
n(Х) m(Х)
С(Х) = ---------- ×1000 = -------------- ×1000, например С(HCl) = 0,1 моль/л или
V М(Х) ×V 0,1М
Молярная концентрация эквивалента – отношение количества вещества эквивалента в растворе к объёму этого раствора или количество молей эквивалента вещества в 1 л раствора. Форма записи СЭ(Х) или С(Эх):
nЭ(Х) m(Х)
СЭ(Х) = -----------×1000 = ------------------×1000, где
V МЭ(Х) × V
nЭ(Х) – количество эквивалентов вещества, моль;
V – объём раствора, мл;
m(Х) и МЭ(Х) – соответственно растворённая и молярная масса эквивалента вещества, г.
При обозначении единиц измерения пишут моль/л или М и указывают фактор эквивалентности или химическую реакцию.
Например, 0,5М Н2SО4(¦экв. = ½). Часто вместо указанного обозначения пишут «н» или используют термин «нормальный раствор»: 0,5н Н2SО4 или 0,5-нормальный раствор Н2SО4.
Молярная концентрация эквивалента всегда больше (¦экв.(Х) > 1) или равна (¦экв.(Х) = 1)молярной концентрации раствора. Связь между ними определяется соотношением:
С(Х)
СЭ(Х)= ------------
¦экв.(Х)
Пример, имеется 0,1М растворН2SО4. Чему равна его молярная концентрация эквивалента, если фактор эквивалентности ¦экв.(Н2SО4) = 1/2?
0,1
СЭ(Н2SО4) = -------- = 0,2М (или С(Н2SО4) = 0,2н)
1/2
Для правильного проведения титриметрического анализа крайне важно определить и рассчитать точную концентрацию применяемого для анализа веществ раствора реагента – титранта. Растворы точной концентрации, предназначенные для титрования, называются титрованными растворами. Наиболее употребительны обозначения концентрации титрантов в виде молярной концентрации или молярной концентрации эквивалента.
В аналитической химии широко используют закон эквивалентов, в соответствии с которым число эквивалентов взаимодействующих и образующихся веществ равно.
Для произвольной реакции:
аА + bB = сC + dD
закон эвивалентов имеет следующие математические выражения:
1) nЭ(А) = nЭ(В) = nЭ(С)= nЭ(D);
2 моль · ½ А = 2 моль · ½ В = 2 моль · ½ С = 2 моль · ½ D = 1 моль
2) Молярная концентрация эквивалентов рассчитывается по формулам:
nЭ.(Х)
СЭ.(Х) = ---------------×1000 =, выражаем
V
значение nЭ(Х), следовательно:
СЭ(А) ·V(А) = СЭ(В) ·V(В)
0,1 моль/л(А)· ½ А ·1л(А) = 0,1 моль/л(В) · ½ В ·1л(В)
0,05 моль(А) = 0,05 моль(В)
Закон эквивалентов лежит в основе титриметрического анализа.
Кроме этого, концентрацию титранта можно выразить с помощью титра (Т) и титра раствора по определяемому веществу.
Титр раствора по определяемому веществу (Т) – масса определяемого вещества (Х) в г, реагирующая с 1 мл раствора титранта (А).
m(Х)
Т(Х) = -----------, г/мл
V(А)
Например, Т(NaОН) = 0,0025г/мл, это значит 1 мл раствора Н2SО4 реагирует с 0,0025 г NaОН.
Титр связан с молярной концентрацией и молярной концентрацией эквивалента титранта (А) следующими соотношениями:
СЭ(А) ·МЭ.(Х)
Т(Х)=-------------------
Данный способ выражения концентрации используют, если титрант применяют для определения только одного вещества. Например, на контроле качества лекарственных средств: определяют массовую долю борной кислоты по 0,1 М NaОН в глазных каплях: Т(NaОН/ Н3ВО3) = 0,00618г/мл
Поправочный коэффициент – число, показывающее, во сколько раз практическая концентрация (навеска) больше или меньше заданной (расчётной, теоретической).
практическая концентрация взятая навеска
К = ------------------------------------- = ------------------------------
теоретическая концентрация теоретическая навеска
Например, необходимо приготовить 100 мл 0,1 М раствора щавелевой кислоты Н2С2О4 ·2Н2О. Фактор эквивалентности ¦экв.(Н2С2О4 ·2Н2О) = 1/2.Расчетная навеска равна 0,6304 г. Практическая навеска взята 0,6310 г. Чему будет равен поправочный коэффициент К?
К =0,6310/ 0,6304 = 1,0010
Обычно указывают теоретическую расчетную концентрацию, а радом указывают поправочный коэффициент К. Для приведенного примера:
СЭ(Н2С2О4 ·2Н2О) = 0,1 М (К=1,0010)
Этот способ выражения концентрации удобен, его применяют в лабораториях.
Рекомендуемая величина К для проведения анализа:
а).Государственная Фармакопея ХI издания:
К= 0,98 – 1,02
б).ГОСТ «Методы приготовления титрованных растворов»:
К= 0,97 – 1,03
При отклонении величины К от указанных пределов титрованный раствор необходимо:
- разбавить: V(H2О) = (К-1) · Vтитранта или
- укрепить: m(Х) = (1-К) · q(Х), где q(Х)- навеска вещества Х в г.
Например, если К = 1,05, значить титрованный раствор нужно разбавить, т.е. добавить воду:
V(H2О) = (1,05-1) ·1000 = 50 мл;
если К= 0,92, значит титрованный раствор нужно укрепить, т.е. добавить вещество, из которого он готовится:
m(Х) = (1-0,92) · 3,65 = 0,292 г.
Мерная посуда
| Стакан с носиком служит для хранения жидких и твердых веществ, а также для проведения простейших химических операций (растворение, нагревание) |
| Колба коническая используется для проведения различных химических операций, например титрования |
| Колба круглодонная служит для проведения разнообразных химических операций при нагревании. |

| Цилиндр используют для измерения объема жидкостей. |
| Воронка конусообразная служит для переливания жидкостей и фильтрования. |

| Стеклянная палочка предназначена для размешивания веществ в химической посуде. Для предохранения посуды от случайного растрескивания при размешивании веществ на конец стеклянной палочки надевают кусочек резиновой трубки. |
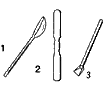
| Ложка фарфоровая (1), шпатель (2) служат для взятия твердых и сыпучих веществ. Ложка-дозатор (3) предназначена для взятия определенной порции вещества. |

| Чашка фарфоровая применяется для выпаривания жидкостей. |
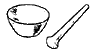
| Ступка с пестиком служат для размельчения и растирания твердых веществ. |

| Штатив для пробирок, служит для размещения в нем пробирок. |

| Зажим пробирочный служит для закрепления пробирки, если вещество в пробирке требуется нагреть в пламени. |
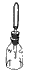
| Склянка с пипеткой служит для хранения растворов реактивов при работе с малыми количествами веществ. |

| Мерная колба, предназначена для приготовления растворов точной концентрации, а также растворов разбавления. |

| Пипетки с делениями на слив от любой отметки до сливного кончика. Применяются для точного отмеривания определенных объемов жидкости. |

| Спиртовка предназначена для нагревания жидкостей. |






