1. Гидратация алкенов:
СH3–CH=CH2+H2О  CH3–CH(ОН)–CH3.
CH3–CH(ОН)–CH3.
2. Гидролиз галогеноалканов:
CH3–CH2–Br + KOH  CH3–CH2–ОН + KBr.
CH3–CH2–ОН + KBr.
3. Восстановление альдегидов и кетонов:
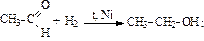
| 
| ||
| альдегид ® | первичный спирт | кетон ® | вторичный спирт |
4. Получение этанола спиртовым брожением сахаристых веществ:
С6Н12О6  2CH3–CH2–ОН + 2СО2.
2CH3–CH2–ОН + 2СО2.
(глюкоза)
5. Получение метанола из синтез-газа (смеси СО и Н2):
СО + 2Н2  CH3–ОН.
CH3–ОН.
Многоатомные предельные спирты
Многоатомные спирты содержат несколько гидроксильных групп, присоединенных к разным атомам углерода. Присоединение нескольких гидроксильных групп к одному атому углерода невозможно, так как при этом происходит процесс дегидратации и образуется соответствующий альдегид или карбоновая кислота:

Примеры многоатомных спиртов:

| 
|
| этандиол (этиленгликоль) двухатомный | пропантриол (глицерин) трехатомный |

| 
|
| ксилит | сорбит |
| заменители сахара |
Многоатомные спирты содержат асимметрические атомы углерода и обладают оптической изомерией.
В качестве примера циклических спиртов можно привести шестиатомные циклические спирты С6Н6(ОН)6 – инозиты, один из изомеров которых (мезоинозит) входит в состав фосфолипидов:

Химические свойства многоатомных спиртов
1. Кислотные свойства
Многоатомные спирты обладают большими кислотными свойствами по сравнению с одноатомными спиртами, что объясняется взаимным влиянием функциональных групп:


гликолят натрия
2. Качественная реакция на многоатомные спирты – взаимодействие со свежеосажденным гидроксидом меди(II):

| |
| голубой осадок | ® темно-синий раствор (глицерат меди) |
3. Образование полных и неполных эфиров с неорганическими и органическими кислотами:
 ;
;

(нитроглицерин);
 .
.
4. Дегидратация многоатомных спиртов
 диоксан
диоксан
Получение многоатомных спиртов
1. Гидролиз дигалогеноалканов:
Br–CH2–CH2–Br + 2KOH  НО–CH2–CH2–ОН + 2KBr.
НО–CH2–CH2–ОН + 2KBr.
2. Окисление алкенов водным раствором перманганата калия (реакция Вагнера):
3CH2=CH2+2KMnO4+4H2O®3HO–CH2–CH2–OH+2MnO2¯+2KOH.
3. Получение глицерина:
 (гидролиз жиров)
(гидролиз жиров)

ФЕНОЛЫ
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца. По числу ОН-групп различают:
· одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи:

| 
| 
| 
| |
| фенол | орто -крезол | мета -крезол | пара -крезол | |
| Еще один изомер состава С7Н7ОН, бензиловый спирт, не относится к фенолам, так как функциональная группа не присоединена непосредственно к ароматической системе. Гидроксильная группа может быть присоединена и к более сложным ароматическим системам, например, | ||||

| 
| 
| ||
| бензиловый спирт | a-нафтол | b-нафтол | ||
- двухатомные фенолы (арендиолы):

| 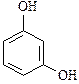
| 
|
| катехол | резорцин | гидрохинон |
- трехатомные фенолы (арентриолы):

| 
| 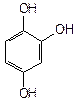
|
| пирогаллол | флороглюцин | оксигидрохинон |
Для фенола и его гомологов возможны два типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Физические свойства.
Фенол – бесцветное кристаллическое вещество, розовеющее на воздухе. Обладает характерным запахом. Хорошо растворяется в воде, этаноле, ацетоне и других органических растворителях. Раствор фенола в воде – карболовая кислота. Другие фенолы – бесцветные кристаллические вещества или жидкости, температуры кипения которых выше температур кипения предельных спиртов с такими же молярными массами. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны.
Химические свойства.
Для структуры фенола характерно взаимодействие неподеленной пары электронов атома кислорода и p-электронов ароматического кольца. Результатом этого является смещение электронной плотности с гидроксильной группы на кольцо, при этом связь О–Н становится более полярной, а значит, менее прочной (фенолы проявляют свойства слабых кислот).
Гидроксильная группа по отношению к бензольному кольцу является заместителем I рода, ориентируя реакции замещения в орто- и пара-положения.
Реакции фенола можно разделить на две группы: реакции с участием функциональной группы и реакции с участием ароматического кольца.
Реакции по гидроксильной группе
1. Кислотные свойства:
2C6H5OH + 2Na ® H2 + 2C6H5ONa (фенолят натрия);
C6H5OH + NaOH ® C6H5ONa + H2O;
C6H5ONa + H2O + CO2 ® C6H5OH + NaHCO3
(кислотные свойства фенола слабее, чем угольной кислоты);


Фиолетовое окрашивание растворов в присутствии хлорида железа(III) – качественная реакция на фенолы.
В том случае, когда гидроксильная группа не связана непосредственно с ароматическим циклом, а находится в составе заместителя, влияние бензольного кольца на функциональную группу ослабевает и кислотные свойства не проявляются (класс ароматических спиртов). Например, бензиловый спирт реагирует с натрием и не реагирует с NaOH.
2. Образование сложных и простых эфиров (в отличие от спиртов фенолы не реагируют с карбоновыми кислотами, сложные эфиры получают косвенным путем – из хлорангидридов кислот и фенолятов): С6Н5ОН + СН3СООН ¹

C6H5ONa + R–Br ® C6H5OR + NaBr
3. Окисление (фенолы легко окисляются даже под действием кислорода воздуха, поэтому при стоянии постепенно окрашиваются в розовый цвет):

| 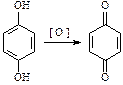
|
| бензохинон |
Реакции по бензольному кольцу.
1. Галогенирование:

(в отличие от бензола и его гомологов фенол обесцвечивает бромную воду).
2. Нитрование:

Тринитрофенол (пикриновая кислота) – кристаллическое вещество желтого цвета, по силе приближается к неорганическим кислотам).
3. Поликонденсация (взаимодействие с формальдегидом и образование фенолформальдегидных смол):

Получение фенола
3. Перегонка каменноугольной смолы.
4. Получение фенола из галогенбензолов:
С6Н5Сl + 2NaOH  C6H5ONa + NaCl + H2O;
C6H5ONa + NaCl + H2O;
C6H5ONa + HCl ® C6H5OH + NaCl.
5. Каталитическое окисление изопропилбензола (кумола) – кумольный метод:
 .
.
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны относятся к карбонильным соединениям и содержат карбонильную группу  . В альдегидах карбонильная группа обязательно связана с атомом водорода (находится в положении 1 углеродной цепи), в кетонах она расположена в середине цепи и связана с двумя атомами углерода. Общая формула альдегидов и кетонов С2H2nO (межклассовые изомеры). Для альдегидов существует только изомерия углеродного скелета, для кетонов – изомерия углеродного скелета и изомерия положения функциональной группы.
. В альдегидах карбонильная группа обязательно связана с атомом водорода (находится в положении 1 углеродной цепи), в кетонах она расположена в середине цепи и связана с двумя атомами углерода. Общая формула альдегидов и кетонов С2H2nO (межклассовые изомеры). Для альдегидов существует только изомерия углеродного скелета, для кетонов – изомерия углеродного скелета и изомерия положения функциональной группы.
Номенклатура альдегидов и кетонов:

| 
| 
| |
| метаналь (формальдегид или муравьиный альдегид) | этаналь (ацетальдегид или уксусный альдегид) | пропаналь (пропионовый альдегид) | |

| 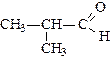
| 
| |
| бутаналь (масляный альдегид) | метилпропаналь (изомасляный альдегид) | пропеналь (акролеин) | |
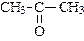
| 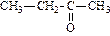
| 
| |
| пропанон (диметилкетон или ацетон) | бутанон (метилэтилкетон) | пентанон-1 (метилпропилкетон) | |

| 
| 
| |
| пентанон-2 (диэтилкетон) | метилбутанон (метилизопропил кетон) | метилфенилкетон (ацетофенон) | |
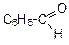
| 
| ||
| бензойный альдегид | дифенилкетон (бензофенон) | ||
Физические свойства
Формальдегид при комнатной температуре – газ, температура кипения ацетальдегида +20°С. Температуры кипения альдегидов ниже, чем температуры кипения соответствующих спиртов (отсутствуют водородные связи между молекулами). Ацетон и его ближайшие гомологи – жидкости, легче воды. Альдегиды и кетоны легко летучи и имеют резкий запах. Раствор формальдегида в воде – формалин.
Химические свойства
Атом углерода карбонильной группы находится в состоянии sp 2-гибридизации (плоский фрагмент). Электроны двойной связи сильно смещены в сторону более электроотрицательного атома кислорода (связь С=О полярная). Перераспределение зарядов в карбонильной группе оказывает влияние на полярность С–Н связей соседнего с карбонильной группой атома углерода (a-положение):

Для альдегидов и кетонов характерны реакции присоединения по двойной связи карбонильной группы и реакции замещения атома водорода у a-атома углерода на галоген. Кроме того, альдегиды способны окисляться по атому водорода при карбонильной группе.
Реакции присоединения по двойной связи С=О группы (нуклеофильное присоединение SN)
В связи с тем, что связь С=О альдегидов и кетонов имеет полярный характер, она легко разрывается под действием полярных молекул типа Н–Х. В общем виде реакцию можно представить в виде:

1. Присоединение водорода (восстановление альдегидов и кетонов до первичных и вторичных спиртов):

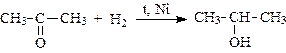
2. Присоединение воды (гидратация) – обратимый процесс (гидраты устойчивы только в водных растворах):

Метаналь в водных растворах гидратирован на 100%, этаналь – на 50%, ацетон практически не гидратирован.
3. Присоединение спиртов:
 (полуацеталь);
(полуацеталь);  (ацеталь).
(ацеталь).
4. Присоединение гидросульфита натрия (реакция служит для выделения альдегидов и кетонов из смесей с другими органическими веществами):

 .
.
5. Присоединение аммиака (H–NH2) и аминов (H–NHR):
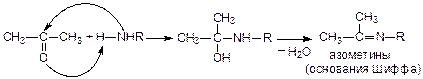
Особым образом происходит присоединение аммиака к уксусному и муравьиному альдегидам:

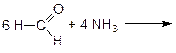

(гексаметилентетрамин – уротропин, дезинфицирующее средство в урологии при воспалении мочевых путей)
5. Присоединение гидразина (H2N–NH2) и фенилгидразина (H2N–NH–С6H5):


5. Присоединение гидроксиламина (NH2OH):

Реакции замещения атома водорода у a-атома углерода
Ослабление связи в СН2-группе углеводородного радикала, соседней с функциональной группой альдегида (a-положение), приводит к тому, что именно эти атомы водорода преимущественно заменяются на галоген:

(сильные лакриматоры – вещества, вызывающие слезоотделение).
Иодоформная проба – качественная реакция на соединения с карбонильной группой:

Так как первичные и вторичные спирты окисляются иодом до альдегидов и кетонов, то для них тоже характерна иодоформная проба:

Конденсация альдегидов и кетонов
Реакции идут с участием карбонильной группы и атома водорода в a-положении.
1. Альдольная конденсация:


2. Кротоновая конденсация:
При нагревании щелочных растворов альдегидов и кетонов продукты альдольной конденсации отщепляют воду (кротоновая конденсация):
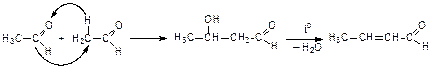

Реакции окисления альдегидов и кетонов
1. Реакция серебряного зеркала (качественная реакция на альдегиды):

2. Реакция с гидроксидом меди (II) (качественная реакция на альдегиды):

Окисление метаналя (муравьиного альдегида) в этих условиях идет до образования карбоната аммония или оксида углерода (IV):


Кетоны в «мягких» условиях (при нагревании с аммиачным раствором оксида серебра или гидроксида меди (II) не окисляются. В «жестких» условиях (нагревание с перманганатом калия или дихроматом калия) окисляются с разрывом углеродной цепи и образованием смеси кислот:

Полимеризация низших альдегидов


Кетоны в реакции полимеризации не вступают.






