Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака.
Реакции трансаминирования являются обратимыми и, как выяснилось позже, универсальными для всех живых организмов. Эти реакции протекают при участии аминотрансфераз. Теоретически реакции трансаминиро-вания возможны между любой амино- и кетокислотой, однако наиболее интенсивно они протекают в том случае, когда один из партнеров представлен дикарбоновой амино- или кетокислотой. Все трансаминазы (как и декарбоксилазы аминокислот) содержат один и тот же кофермент – пиридоксальфосфат. Для реакций трансаминирования харак -терен общий механизм. Специфичность трансаминаз обеспечивается белковым компонентом. Ферменты трансаминирования катализируют перенос NH2-группы не на α-кетокислоту, а сначала на кофермент пиридоксаль-фосфат. Образовавшееся промежуточное соединение (шиффово основание) подвергается внутримолекулярным превращениям (лабилизация α-водо-родного атома, перераспределение энергии связи), приводящим к освобождению α-кетокислоты и пиридоксаминфосфата; последний на второй стадии реакции реагирует с любой другой α-кетокислотой, что через те же стадии образования промежуточных соединений (идущих в обратном направлении) приводит к синтезу новой аминокислоты и освобождению пиридоксальфосфата. Опуская промежуточные стадии образования шиф-фовых оснований, обе стадии реакции трансаминирования можно представить в виде общей схемы: 
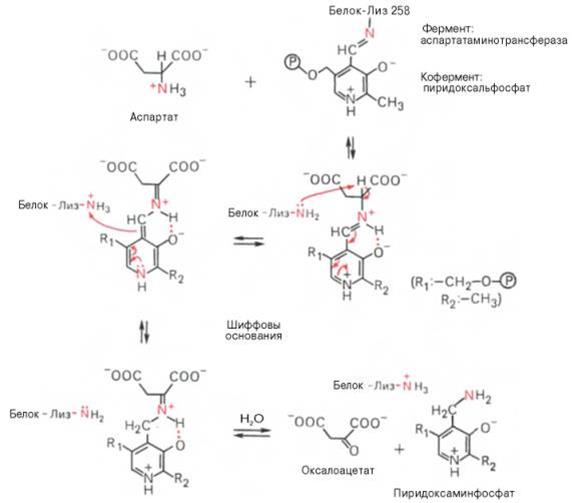
В связи с тем что во всех пиридоксалевых ферментах (включая транс-аминазы) карбонильная группа кофермента (—СНО) оказалась связанной с ε-аминогруппой лизина белковой части, в классический механизм реакции трансаминирования А.Е. Браунштейн и Э. Снелл внесли следующее дополнение. Оказалось, что взаимодействие между субстратом, т.е. L-амино-кислотой (на рисунке – аспартат), и пиридоксальфосфатом происходит не путем конденсации с выделением молекулы воды, а путем реакции замещения, при которой NH2-группа субстрата вытесняет ε-NН2-группу лизина в молекуле ферментного белка, что приводит к формированию пиридоксальфосфатного комплекса.
Аминотрансферазы (трансаминазы) — ферменты, катализирующие межмолекулярный перенос аминогруппы от соответствующих аминокислот на a‑кетокислоты (2‑оксокислоты) с образованием новых кето- и аминокислот без образования свободного аммиака, в качестве кофермента используется витамин В6 (пиридоксин). Эти ферменты играют центральную роль в обмене белков, осуществляя окислительное дезаминирование аминокислот опосредованно через глутаминовую кислоту. Образующаяся глутаминовая кислота дезаминируется глутаматдегидрогеназой с освобождением свободного аммиака и 2‑оксоглутаровой кислоты. В организме человека наибольшее значение имеют две аминотрансферазы: аспартатаминотрансфераза (АСТ или АсАТ) (L‑аспартат:2‑оксоглутарат-аминотрансфераза, КФ 2.6.1.1.) и аланинаминотрансфераза (АЛТ или АлАТ), (L‑аланин:2‑оксоглутарат-аминотрансфераза, КФ 2.6.1.2.). В клинической практике чаще всего определяют именно активность этих двух ферментов. Существует также другое название указанных ферментов: для АСТ — глутаматоксалоацетатаминотрансфераза (ГОАТ), для АЛТ — глутаматпируватаминотрансфераза (ГПАТ). Ниже приведены реакции, катализируемые этими ферментами:
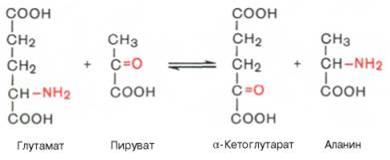
2-Оксоглутарат + Аспартат ↔ Глутамат + Оксалоацетат
2-Оксоглутарат + Аланин ↔ Глутамат + Пируват
Наибольшая активность АСТ обнаружена в миокарде, затем в порядке убывания в печени, скелетных мышцах, головном мозге, почках. Активность фермента в миокарде в 10000 раз выше, чем в сыворотке крови. Фермент является димером, имеет изоферменты: положительно заряженный митохондриальный с ММ=93 кД и отрицательно заряженный цитозольный с ММ=92 кД. Активность АЛТ максимальна в печени, среди других органов убывает в последовательности: поджелудочная железа, сердце, скелетные мышцы, селезенка, легкие. Фермент также имеет цитозольный и митохондриальный изоферменты, однако последний содержится в минимальном количестве и нестабилен. Избирательная тканевая локализация позволяет считать трансаминазы маркерными ферментами: АСТ для миокарда, АЛТ для печени. Соотношение активности аминотрансфераз позволяет судить о глубине повреждения клеток: АЛТ преимущественно локализована в цитоплазме, АСТ — в цитоплазме и в митохондриях.
Константа равновесия ферментативной реакции трансаминирования приблизительно равна 1, то есть направление протекания процесса переноса аминогруппы определяется концентрацией субстратов и продуктов в клетке. Одна и та же реакция трансаминирования может протекать в разных направлениях в разных частях клетки. Следовательно трансаминирование служит как для анаболизма, так и для катаболизма аминокислот, то есть является амфиболическим процессом.
Лизин и треонин не участвуют в реакциях трансаминирования.
Продуктами чаще всего являются аланин, аспарагин и глутамат, так как соответствующие им кетокислоты образуются в процессе метаболизма углеводов. Трансаминирование играет важную роль в процессах мочевинообразования, глюконеогенеза, путях образования новых аминокислот. Трансаминирование аминокислот с образованием глутаминовой кислоты в сочетании с ёё дезаминированием НАД(Ф)-зависимой глутаматдегидрогеназой называется непрямым дезаминированием аминокислот (трансдезаминирование).
Билет 14
1.Витамин В12. Биологическая роль. Пути попадания в организм. Коферментная функция.
Витаминами B12 называют группу кобальтсодержащих биологически активных веществ, называемых кобаламинами. К ним относят собственно цианокобаламин — продукт, получаемый при химической очистке витамина цианидами, гидроксикобаламин и две коферментные формы витамина B12: метилкобаламин и 5-дезоксиаденозилкобаламин. B12 имеет самую сложную по сравнению с другими витаминами структуру, основой которой является корриновое кольцо. Коррин во многом аналогичен порфирину (сложной структуре, входящей в состав гема, хлорофилла и цитохромов), но отличается от порфирина тем, что два пиррольных цикла в составе коррина соединены между собой непосредственно, а не метиленовым мостиком. В центре корриновой структуры располагается ион кобальта. Четыре координационных связи кобальт образует с атомами азота. Ещё одна координационная связь соединяет кобальт с диметилбензимидазольным нуклеотидом. Последняя, шестая координационная связь кобальта остаётся свободной: именно по этой связи и присоединяется цианогруппа, гидроксильная группа, метильный или 5'-дезоксиаденозильный остаток с образованием четырёх вариантов витамина B12, соответственно. Ковалентная связь углерод-кобальт в структуре цианокобаламина — единственный в живой природе пример ковалентной связи металл-углерод. В природе продуцентами этого витамина являются бактерии и археи. Ковалентная связь C-Co кофермента B12 участвует в двух типах ферментативных реакций:
- Реакции переноса атомов, при которых атом водорода переносится непосредственно с одной группы на другую, при этом замещение происходит по алкильной группе, спиртовому атому кислорода или аминогруппе.
- Реакции переноса метильной группы (-CH3) между двумя молекулами.
В организме человека есть только два фермента с коферментом B12:
- Метилмалонил-КоА-мутаза, фермент, использующий в качестве кофактора аденозилкобаламин и при помощи реакции, упомянутой выше в п.1, катализирует перестановку атомов в углеродном скелете. В результате реакции из L-метилмалонил-КоА получается сукцинил-КоА. Эта реакция является важным звеном в цепи реакций биологического окисления белков и жиров.
- 5-метилтетрагидрофолат-гомоцистеин-метилтрансфераза, фермент из группы метилтрансфераз, использующий в качестве кофактора метилкобаламин и при помощи реакции, упомянутой выше в п.2, катализирует превращение аминокислоты гомоцистеина в аминокислоту метионин.
Ни животные, ни растения не способны синтезировать витамин В12. Это единственный витамин, синтезируемый почти исключительно микроорганизмами: бактериями, актиномицетами и сине-зелёными водорослями. Из животных тканей наиболее богаты витамином В12 печень и почки. Хотя этот витамин вырабатывается микроорганизмами в пищеварительном тракте любого животного, включая человека, как продукт деятельности микрофлоры, однако он не может усваиваться, так как образуется в толстой кишке и не может попасть в тонкую кишку. Поэтому витамин B12 человек получает в основном с животной пищей, в том числе с мясом, рыбой, яйцами и молочными продуктами. Источником кобаламинов также могут быть обогащённые ими продукты: например, для вегетарианцев и веганов, таким источником являются сухие завтраки, пивные дрожжи и пищевые дрожжи, искусственно обогащённые витамином B12; витаминизированные хлопья и изделия из дроблёного зерна, а также специальные добавки. В пищевой промышленности многих стран витамин добавляют в такие продукты, как сухие завтраки, шоколадные батончики, энергетические напитки.
Витамин В12 выполняет коферментные функции. В организме человека есть две коферментные формы витамина В12 (кобаламина): метилкобаламин — в цитоплазме и дезоксиаденозилкобаламин — в митохондриях. В метилкобаламине вместо аденозильной группы, связанной с атомом кобальта (см. рис. 6.1), имеется метальная группа. В развитии анемии основная роль принадлежит дефициту ме-тилкобаламина, который служит коферментом в реакциях трансметилирования (подробнее об этих реакциях см. в гл. 11). Реакции траснметилирования происходят, в частности, при синтезе нуклеотидов и нуклеиновых кислот. Поэтому при недостатке метилкобаламина синтез нуклеиновых кислот нарушается. Это проявляется прежде всего в тканях с интенсивной клеточной пролиферацией. К их числу относится и кроветворная ткань. Деление и созревание клеток эритроци-тарного ряда нарушаются, размеры клеток превышают нормальные, значительная часть клеток — предшественников эритроцитов разрушается еще в костном мозге. В циркулирующей крови количество эритроцитов резко уменьшено, размеры их увеличены. При отсутствии лечения наступают изменения и в других тканях, и болезнь заканчивается гибелью больного. Введение 100-200 мкг витамина В12 ежедневно в течение примерно двух недель излечивает болезнь.
Другая коферментная форма витамина В12 — дезоксиаденозилкобаламин, участвует в метаболизме метилмалоновой кислоты, которая получается в организме из жирных кислот с нечетным числом углеродных атомов, а также из аминокислот с разветвленной углеродной цепью (подробнее об этом см. в гл. 10). При дефиците витамина В12 метилмалоновая кислота накапливается в организме и в больших количествах выводится с мочой; ее определение в моче используется для диагностики злокачественной анемии.






