Процесс окисления жирной кислоты в митохондриях клетки включает несколько последовательных энзиматических реакций.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окисление ацил-КоА-де-гидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:

Существует несколько ФАД-содержащих ацил-КоА-дегидрогеназ, каждая из которых обладает специфичностью по отношению к ацил-КоА с определенной длиной углеродной цепи.
Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):
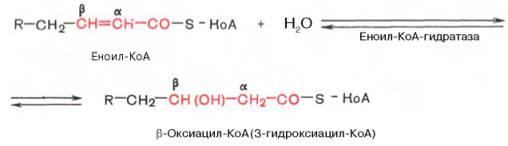
Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата. В результате гидратации транс-Δ2-двойной связи образуется только L-изомер 3-гидроксиацил-КоА.
Вторая стадия дегидрирования. Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакцию катализируют НАД+-зависимые дегидрогеназы:

Тиолазная реакция. В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакцияпредставляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):
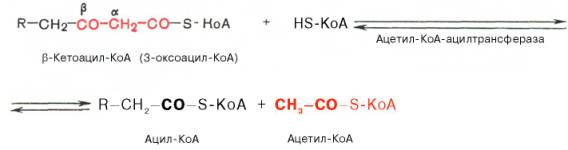
Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА (рис. 11.2). Например, при окислении пальмитиновой кислоты (С16) повторяется 7 циклов β-окисления. Запомним, что приокислении жирной кислоты, содержащей п углеродных атомов, происходит n/2–1 цикл β-окисления (т.е. на один цикл меньше, чем n/2, так как при окислении бутирил-КоА сразу происходит образование 2молекул ацетил-КоА) и всего получится п/2 молекул ацетил-КоА. Следовательно, суммарное уравнение β-окисления активированной кислоты можно записать так:
Пальмитоил-КоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA –>
–> 8Ацетил-КоА + 7ФАДН2 + 7НАДН + 7Н+.
Баланс энергии. При каждом цикле β-окисления образуются одна молекула ФАДН2 и одна молекула НАДН. Последние в процессе окисления вдыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Таким образом, всего при полном β-окислении пальмитиновой кислоты образуется 35 + 96 = 131 молекула АТФ. С учетом одной молекулы АТФ, потраченной в самом начале на образование активной формы пальмитиновой кислоты (пальмитоил-КоА), общий энергетический выход при полномокислении одной молекулы пальмитиновой кислоты в условиях животного организма составит 131 – 1 = 130 молекул АТФ. Изменение свободной энергии ΔF при полном сгорании 1 моля пальмитиновой кислоты составляет 2338 ккал, а богатая энергией фосфатная связь АТФ характеризуется величиной 7,6 ккал/моль. Нетрудно подсчитать, что примерно 990 ккал (7,6 х 130), или 42% от всей потенциальной энергии пальмитиновой кислотыпри ее окислении в организме, используется для ресинтеза АТФ, а оставшаяся часть, очевидно, теряется в виде тепла.
Следовательно, эффективность накопления энергии в результате окисления жирных кислот при стандартных условиях составляет ~ 40%, что близко к соответствующей величине для гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования.
Биосинтез мочевины.
Мочевина является главным конечным продуктом обмена аминокислот. Синтезируется мочевина из аммиака, который постоянно образуется в организме при окислительном и неокислительном дезаминировании аминокислот, при гидролизе амидов глутаминовой и аспарагиновой кислот, а также при распаде пуриновых и пиримидиновых нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего - на центральную нервную систему. Несмотря на то, что аммиак постоянно продуцируется в тканях, он содержится в периферической крови лишь в следовых количествах, так как быстро удаляется из кровеносной системы печенью, где входит в состав глутамата, глутамина и мочевины. Биосинтез мочевины является основным механизмом обезвреживания аммиака в организме. Синтез мочевины происходит в печени в цикле Кребса-Гензелейта (другое название - орнитиновый цикл мочевинообразования Кребса) в несколько этапов с участием ряда ферментных систем. Синтез сопровождается поглощением энергии, источником которой является АТФ.
Весь цикл мочевинообразования можно представить следующим образом:
На первом этапе синтезируется карбамоилфосфат в результате конденсации ионов аммония, двуокиси углерода и фосфата (поступающего из АТФ) под действием фермента карбамоилсинтетазы. Карбамоилфосфат - это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза ряда других азотистых соединений.
На втором этапе мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитинкарбамоилтрансфераза.
На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая, сводится к конденсации цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинатсинтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента - аргининосукцинатлиазы.
На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменении количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.) также сопровождаются активацией орнитинового цикла.
Нормальный ход метаболического превращения аммиака в мочевину имеет большое значение для организма. При серьезных нарушениях функции печени - например, при обширном циррозе или тяжелом гепатите - аммиак, являясь токсичным веществом, накапливается в крови, вызывая тяжелые клинические симптомы. Известны врожденные метаболические нарушения, связанные с недостатком одного из ферментов, участвующих в синтезе мочевины. Все нарушения синтеза мочевины вызывают аммиачное отравление.
Синтезированная в печени мочевина попадает в кровь, затем в почки и в итоге выводится с мочой. Мочевина является беспороговым веществом: все образующееся количество фильтруется в просвет проксимальных канальцев, а затем часть (около 35 %) реабсорбируется обратно за счет реабсорбции воды. В связи с этим величина экскреции мочевины является менее информативным показателем клубочковой фильтрации, чем показатель, основывающийся на экскреции креатинина (который, в отличие от мочевины, практически не реабсорбируется).

Рис. 12.5. Орнитиновый цикл синтеза мочевины в печени.
Аммиак образуется главным образом в процессе глутаматде-гидрогеназной реакции. В процессе пополнения запасов аспартата участвуют три сопряженные реакции: сначала фумарат под действием фумаразы присоединяет воду и превращается в малат, который окисляется при участии малатдегидрогеназы с образованием оксалоацетата; последний в реакции трансаминирования с глутаматом вновь образует аспартат.
Учитывая известные фактические данные о механизмах обезвреживания аммиака в организме, можно сделать следующее заключение. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования α-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот.
Билет №16
Витамин А.
Каротиноиды объединяют группу производных растительных пигментов каротинов. Наибольшее значение имеет ретинол (А1) и дегидроретинол (А2). Среди биологически активных соединений важнейшими считаются α-, β- и γ-каротины. Наибольшую ценность для организма представляет β-каротин, который содержит 2 β-ионовых кольца, соединенных цепью, состоящей из 18 атомов углерода (из 4 частиц изопрена). Этот каротин широко распространен в природе.
Молекула витамина А содержит только одно β-ионовое кольцо, а боковая цепь состоит из 2 частей изопрена. Молекула витамина А представляет собой половину молекулы β-каротина, который является провитамином витамина А. Провитамином обычно называют непосредственный предшественник, из которого образуется витамин. Поскольку в молекуле витамина А есть гидроксильная группа, он является высокомолекулярным циклическим одноатомным ненасыщенным первичным спиртом. Превращение β-каротина в витамин А происходит преимущественно в стенке тонкой кишки, а также в печени. В этих органах есть и специфический фермент, катализирующий гидролитический распад β-каротина на 2 молекулы А-альдегида-15-15׳-каротин-диоксигеназа. В 1937 году из печени пресноводных рыб был выделен витамин, из которого в цикле на 2 атома водорода меньше, чем у витамина А1. Его назвали витамином А2, дегидроретинолом. А1 и А2 обладают одинаковым биологическим действием и физико-химическими свойствами, только витамин А2 менее активен. Оба витамина получены в чистом виде и синтезированы.

Они хорошо растворяются в жирах и жировых растворителях, достаточно устойчивы к действию щелочей. Витамин А термостабилен, может выдерживать стерилизацию без доступа кислорода. На воздухе он быстро окисляется и разрушается, особенно в кислой среде. Этому способствует также солнечное освещение.. Биологически активными формами витамина А в организме человека и животных могут быть витамин А-спирт, витамин А-альдегид, витамин А-кислота, а также эфиры витамина А. В кишки витамин А попадает в виде эфира, все другие формы образуются уже в тканях. Каждая из этих структур играет определенную роль в обмене веществ, формировании структуры и функциях клеток. Например, витамин А-спирт (в виде эфиров с жирными кислотами) является основным резервом витамина А в тканях, витамин А-альдегид нужен для образования зрительных пигментов, а витамин А-кислота – для нормального роста животных и некоторых других процессов.
Одной из важных функций витамина А является его участие в образовании сложного белка родопсина (зрительного пурпура) сетчатки глаза. Родопсин, имеющийся в палочках, и являющийся фоточувствительным пигментом, состоит из белка опсина и альдегидной формы витамина А – ретиналя. Ретиналь образуется отщеплением 2 атомов водорода от первичной спиртовой группы витамина; он может находиться в цис- и транс-формах. Под действием света цис-ретиналь переходит в транс-ретиналь, после чего родопсин распадается на белок опсин и ретиналь. В темноте эти части снова соединяются, благодаря чему создается возможность видеть в сумерках и ночью. При отщеплении ретинола от родопсина часть его разрушается, поэтому для ресинтеза молекулы родопсина нужны новые молекулы витамина А. Если их нет, то образование ретинола, а в связи с этим и родопсина, затормаживается. В результате этого человек теряет способность видеть в сумерках, т.е. развивается «куриная слепота». Витамин необходим для синтеза нуклеиновых кислот и белков, в частности, белков сыворотки крови, для нормального обмена липидов (в митохондриях печени при А-гиповитаминозе обнаружено уменьшение содержания общих липидов и фосфолипидов, непредельных жирных кислот (арахидоновой и линоленовой) при одновременном увеличении содержания холестерина и триглицеридов). Витамин А влияет на активность ферментов тканевого дыхания и на процессы окислительного фосфорилирования, а также на обмен минеральных веществ, в частности, солей кальция. Каротины в иммунной системе повышают защитную силу собственных интерферонов организма против возбудителей болезней. Прежде всего они защищают от свободных радикалов вилочковую железу, которая представляет собой штаб-квартиру иммунной системы.
Витамин А обнаружен только в организме человека и животных. В растениях содержатся его провитамины – каротины. Всасывание витамина А в кишках происходит при участии желчных кислот. Все факторы, нарушающие переваривание и всасывание жиров, задерживают всасывание каротина и витамина А. Витамин А переносится кровью в комплексе с белком-переносчиком, т.н. ретинол-связывающим протеином (РСП). При недостатке белка в диете снижается депонирование витамина А в печени и образование его из β-каротина. Основным депо витамина А является печень, где он откладывается в виде белково-витаминных комплексов. В печени же основная масса β-каротина превращается в витамин А. Важнейшие источники витамина А: печень, сливочное масло, сливки, сыр, яичный желток, рыбий жир.






