Молекулярно-кинетические свойства золей связаны с движением частиц дисперсной фазы. Особенности молекулярно-кинетических свойств золей зависят в основном от степени дисперсности частиц (от величины их) и проявляются в сотни и тысячи раз слабее, чем у истинных растворов.
Броуновское движение выражается в том, что частицы дисперсной фазы под влиянием ударов молекул растворителя находятся в состоянии непрерывного хаотического движения. Впервые его обнаружил английский ботаник Р.Броун, наблюдая за пыльцой растений в воде. Чем меньше размер частиц, тем интенсивнее их броуновское движение. Следовательно, броуновское движение золей замедленно по сравнению с таковым истинных растворов. С повышением температуры интенсивность броуновского движения возрастает.
Диффузия – это самопроизвольный процесс выравнивания концентрации дисперсной фазы по всему объему дисперсионной среды за счет броуновского движения. Скорость диффузии прямо пропорциональна степени невыравненности концентрации и зависит также от величины и формы частиц, температуры и обратно пропорциональна размеру частиц и вязкости дисперсионной среды. Таким образом, при одинаковой температуре скорость диффузии в коллоидных растворах будет в сотни и тысячи раз меньше, чем в истинных.
Процессы диффузии играют важную роль в организме, прежде всего, участвуя в перемещении питательных веществ, продуктов обмена и т.д. Так, продукты переваривания пищи попадают в капилляры кровеносных сосудов путем диффузии их из латеральных клеток стенки кишечника в указанные капилляры. Скорость многих процессов в организме зависит от скорости диффузии реагирующих веществ, а не от химических реакций, которые при участии ферментов (биологических катализаторов) происходят с огромной скоростью.
Осмотическое давление
В природе растворы часто разделены мембраной, проницаемой только для молекул растворителя. В таких случаях между ними возникает явление, называемое осмосом. Осмос – это самопроизвольное проникновение молекул растворителя через мембрану из растворителя в раствор или из раствора с низкой концентрацией в раствор с более высокой концентрацией вещества.
Для возникновения осмоса необходимо растворы разных концентраций привести в соприкосновение через полупроницаемые мембраны, роль которых для водных растворов могут выполнять как животные и растительные мембраны (оболочка бычьего пузыря, стенки кишечника, оболочки клеток), так и искусственные мембраны (пленки из коллодия, целлофана, железистосинеродистой меди).
Простейший способ измерения избыточного гидростатического давления представлен на рис.1.6.
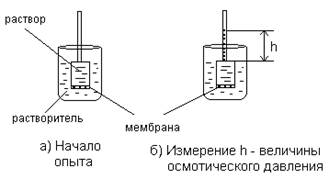
Рис. 1.6. Измерение избыточного гидростатического давления
Высота столба жидкости в цилиндрической трубке прибора (площадь сечения берется равной 1 см2), при которой устанавливается динамическое равновесие, определяет осмотическое давление раствора.
Осмотическое давление прямо пропорционально числу молекул или коллоидных частиц, содержащихся в единице объема раствора, т.е. оно прямо пропорционально концентрации раствора. Кроме того, осмотическое давление прямо пропорционально температуре. Вант-Гофф объединил две эти закономерности, сведя их в одну формулу (уравнение Вант-Гоффа):
π = с. R. T, где
π – осмотическое давление;
с – концентрация раствора, моль/л;
R – коэффициент пропорциональности (универсальная газовая
постоянная).
Если концентрация раствора равна 1 моль/л, то согласно закону Вант Гоффа осмотическое давление этого раствора при Оо С будет равно:
Атм.
Если учесть, что коллоидные частицы во много раз крупнее частиц истинных растворов, то при одной и той же весовой концентрации этих растворов в единице объема золя частиц содержится намного меньше, чем в таком же объеме истинного раствора. Следовательно, осмотическое давление в золях очень мало по сравнению с таковым истинных растворов. Так, осмотическое давление 1%-го раствора глюкозы равно 509 мм ртутного столба, тогда как давление 1%-го золя оксида мышьяка (Аs2О3) – 0,026 мм рт. ст.
Пример. Вычислить осмотическое давление 0,5 М раствора сахарозы при 37о С.
Осмотическое давление вычисляем по формуле:
π = с. R. T
π = 0,5 . 0,082 . (273+37) = 0,5 . 0,082 . 310 = 12,7 (атм.)
Кроме того, золи характеризуются очень малым понижением температуры замерзания и повышением температур кипения по сравнению с этими свойствами истинных растворов.






