Цитохромы представляют собой группу небольших гeмопротеинов, у которых в отличие от гемоглобина и миоглобина, атом железа, входящий в состав их гема, легко подвергается обратимому окислению и восстановлению. Это свойство придает им чрезвычайно важное биологическое значение при переносе электронов. Цитохромы содержатся во всех животных, растениях и аэробных микроорганизмах. На основании природы простетической группы и способа ее связи с белками цитохромы можно разделить на четыре главные группы: а, b, с и d.
Хлорофиллы
Хлорофиллы, связанные с белками (от гр. Chloros ‒ зелёноватый + phyllon ‒ лист), ‒ зелёные пигменты растений. Основу молекулы хлорофилла составляет магний-порфириновый комплекс, окружённый заместителями – фитолом, придающим молекуле хлорофилла способность встраиваться в липидный слой мембраны клетки. Существует несколько типов хлорофиллов, отличающихся системой сопряжённых связей и заместителями. Высшие растения и водоросли в качестве основного пигмента содержат хлорофилл a, в качестве сопровождающих дополнительных ‒ хлорофилл b (высшие растения и зелёные водоросли), хлорофилл c (бурые и диатомовые водоросли), хлорофилл d (красные водоросли).
Флавопротеины
Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми производными – окисленными флавинмононуклеотидами (FMN) и флавинадениндинуклеотидами (FAD). Флавопротеины входят в состав оксидоредуктаз. Некоторые флавопротеины содержат ионы металлов. Представителями флавопротеинов, содержащими также негемовое железо, являются ксантиноксидаза, сукцинатдегидрогеназа.
ЛЕКЦИЯ 9
СЛОЖНЫЕ БЕЛКИ
Гликопротеины
Гликопротеины составляют большую группу сложных белков, содержащих в качестве простетической части углеводы и/или их производные, ковалентно-связанные с белком. При гидролизе гликопротеинов в углеводном компоненте обнаруживаются такие моносахариды, как D-галактоза, D-манноза, D-глюкоза, N-ацетилгалактозамин, N-ацетилглюкозамин и др.
Небольшие олигосахаридные группы могут присоединяться к белкам через O-гликозидную связь к гидроксилам остатков серина и треонина (рис. 9.1).
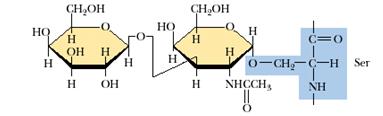
Рис.9.1. О-гликозидная связь в гликопротеинах
В ряде белков встречаются N-гликозидные связи с амидными группами Asn, реже Gln или NH2 группами Lys и Arg (рис.9.2).
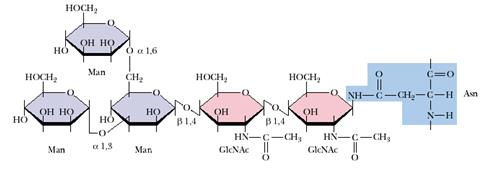
Рис. 9.2. N-гликозидная связь в гликопротеинах
По соотношению белковой и углеводной частей гликопротеины подразделяются на нейтральные и кислые. В нейтральных гликопротеинах углеводная часть может составлять от 3% до 15%, а у некоторых гликопротеинов 40%. К нейтральным гликопротеинам относятся яичный белок (овальбумин), гликопротеины плазмы крови (трансферрин, церуллоплазмин), белок щитовидной железы (тиреоглобулин).
В состав кислых гликопротеинов помимо амино и моносахаров входит уроновая кислота, которая имеет большое биологическое значение, принимая участие в обезвреживании билирубина и ряда ксенобиотиков, в том числе лекарственных средств. Важнейшими кислыми гликопротеинами являются гликопротеины, содержащие в составе гиалуроновые кислоты. Повторяющейся структурной единицей гиалуроновой кислоты служит дисахарид, состоящий из ацетилглюкозамина и глюкуроновой кислоты, соединенных β(1→3)-глюкозидной связью:
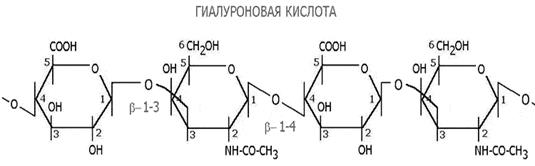
Отдельные дисахаридные остатки соединяются в цепь β(1→4)-глюкозидными связями. В глюкуроновой кислоте карбоксильная группа находится в ионизированном состоянии, поэтому гиалуроновая кислота является чрезвычайно гидрофильным соединением, удерживающим большое количество воды. Её растворы обладают высокой вязкостью.
Важным углеводным компонентом гликопротеинов является также хондроитинсерная кислота или хондроитинсульфат-полимер, состоящий из ацетилгалактозамина, этерифицированного серной кислотой и глюкуроновой кислоты. Ацетилгалактозамин и глюкуроновая кислота соединяются между собой β(1→3) глюкозидной связью:
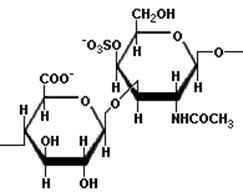
хондроитин -4-сульфат
Хондроитинсульфаты составляют целые семейства (А, В, С), содержащиеся в качестве компонентов соединительной ткани. Их структуры различаются по положению сульфатных остатков, соотношению глюкуроновой кислоты, N-ацетил-D-галактозамина и сульфата. В хрящевой ткани хондроитинсульфаты связываются с особым белком в виде хондромукоида; в костной ткани образуют осцемукоид. Хондроитинсульфаты относятся к мукополисахаридам с молекулярной массой в пределах от 50 до 100 кДа.
Муцины – мукополисахариды, полужидкие слизеобразные вещества, вырабатываемые пищеварительными железами, которые в комплексе с особыми белками играют важную роль в предохранении стенок пищеварительного тракта от механических, химических повреждений и самопереваривания. В состав мукоитинсульфата входит дисахаридный остаток, построенный из маннозамина и глюкуроновой кислоты, причем маннозамин этерифицирован двумя, тремя остатками серной кислоты.
Из природных источников животного и растительного происхождения выделены различные гликопротеины, выполняющие разнообразные функции: защитные (антитела, иммуноглобулины); регуляторные (фолликулстимулирующий, соматотропный гормоны); транспортные (трансферрин, церуллоплазмин, тиреоглобулин); гомеостатические (гепарин); структурные (гликофорин, муреин); образуюшие рецепторы и др.
Особую группу гликопротеинов составляют протеогликаны, в составе которых углеводный компонент преобладает и на его долю приходится от 80% и выше. Более того, эти вещества по своим свойствам более сходны с полисахаридами, чем с белками. Все они содержат глюкозамины или галактозамины.
В межклеточном матриксе содержатся крупные протеогликаны – агрекан и версикан. Кроме них в межклеточном веществе имеется целый набор так называемых малых протеогликанов. Агрекан – основной протеогликан хрящевого матрикса, составляющего 10% исходной ткани и 25% сухого хрящевого матрикса. Это очень крупная молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератинсульфатов. По форме молекула агрекана напоминает «ершик для мытья бутылок». В хрящевой ткани молекулы агрекана собираются в агрегаты с гиалуроновой кислотой и небольшим связывающим белком.
Оба компонента присоединяются к агрекану нековалентными связями в области определенного домена, взаимодействующего примерно с пятью дисахаридными единицами гиалуроновой кислоты. Далее этот комплекс стабилизируется связывающим белком.
Малые протеогликаны – протеогликаны с низкой молекулярной массой. Они содержатся в хрящях, сухожилиях, связках, менисках, коже и других видах соединительной ткани, имеют небольшой коровый белок, к которому присоединены одна или более цепи глизоамингликанов. Наиболее изучены декорин, бигликан, фибромодулин, люмикан, перликан. Коровые белки бигликана и декорина похожи по размерам и структуре. Они имеют несколько тандемных повторов, богатых лейцином, которые образуют α-спирали и β-структуры. На N- и C-концах этих белков расположены домены, содержащие S-S-связи.
Малые протеогликаны являются мультифункциональными макромолекулами. Они могут связываться с другими компонентами соединительной ткани и оказывать влияние на их строение и функции. Например, декорин и фибромодулин присоединяются к фибриллам коллагена второго типа и ограничивают их диаметр, препятствуя образованию толстых фибрилл. Присоединение декорина и бигликана к фибронектину подавляет клеточную адгезию, а присоединение фактора роста опухолей β снижает его митогенную активность. Малые протеогликаны играют важную роль в развитии и регенерации соединительной ткани.
Фосфопротеины
Простетической группой фосфопротеинов является ортофосфорная кислота. Остатки фосфорной кислоты присоединяются к молекуле белка сложноэфирными связями по месту гидроксильных групп оксиаминокислот – серина и треонина. Чаще всего в фосфопротеинах преобладает именно соединения фосфорной кислоты с серином.
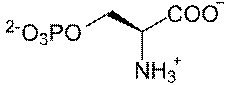
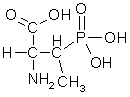
Остаток фосфосерина Остаток фосфотреонина
В фосфопротеинах выявлены пирофосфатные и фосфодиэфирные остатки, наличие которых указывает на то, что пептидные цепи могут быть соединены не только дисульфидными мостиками,но и остатками фосфорной кислоты.
С биологической точки зрения фосфопротеины являются питательными веществами необходимыми для растущего организма. Прежде всего фосфопротеины вместе с необходимым пулом аминокислот участвуют в формирование скелета. Типичными представителями этих сложных белков являются казеины, существующие в нескольких формах и различающиеся между собой по содержанию фосфата и аминокислотным составом. Несколько различных фосфопротеинов найдено среди белков яиц: овальбумин – фосфопротеин яичного белка, вителленин и фосвитин, выделенные из яичного желтка. Ихтулин, обнаруженный в икре рыб, играет немаловажную роль в развитии эмбриона рыб. Пепсин, являясь протеолитическим ферментом, относится к фосфопротеинам и содержит одну молекулу фосфорной кислоты на одну молекулу этого белка. Фосфатная группа присоединяется к радикалу серина, находящемуся в пептидной цепи рядом с глутаминовой кислотой. Фосфопротеинами являются также ферменты фосфоглюкомутаза и фосфорилаза.
Липопротеины
Липопротеины – высокомолекулярные структуры, большинство из которых являются транспортной формой липидов. Липопротеины состоят из белков и липидов (рис. 9.3). В отличие от липидов, липопротеины растворимы в воде и нерастворимы в органических растворителях. Прочность связи белков с липидами в липопротеинах неодинакова и зависит от того, есть ли в молекуле липида ионизированные группы атомов. Липопротеины широко представлены в плазме крови, нервной ткани, молоке, участвуют в построении плазматических мембран. Все типы липопротеинов имеют сходное строение: гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов – фосфолипидов и холестерина. Гидрофильные группы этих молекул ориентированы в водную фазу, а гидрофобные части – к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.
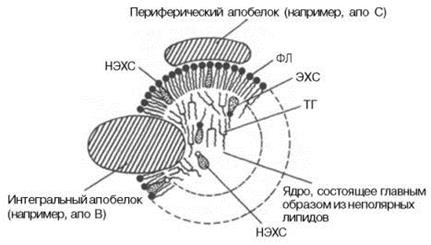
Рис. 9.3. Схема строения липопротеиновой частицы: НЭСХ – неэтерифицированный (свободный) холестерин, ЭХС – этерифицированный холестерин, ТГ – триацилглицеролы, ФЛ – фосфолипиды
Некоторые апопротеины интегральны и не могут быть отделены от липопротеина, а другие могут свободно переноситься от одного типа липопротеина к другому. В липопротеинах апопротеины выполняют несколько функций: формируют структуру липопротеина; взаимодействуют с рецепторами на поверхности клеток; определяют какими тканями будет захвачен липопротеин; служат ферментами или активаторами ферментов, действующих на липопротеин.
В организме синтезируются следующие липопротеины: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП), см.табл. 9.1.
Таблица 9.1
Состав и некоторые характеристики липопротеинов плазмы крови
| Типы липопротеинов | Хиломикроны | ЛПОНП | ЛППП | ЛПНП | ЛПВП |
| Белки, % | |||||
| ФЛ, % | |||||
| ХС, % | |||||
| ЭХС, % | |||||
| ТАГ, % | |||||
| Функции | Транспортирование липидов из клеток кишечника | Транспортирование липидов, синтезируемых в печени | Промежуточная форма превращения ЛПОНП в ЛПНП под действием фермента ЛП-липазы | Транспортироние холестерина в ткани | Удаление избытка холестерина из клеток и других липопротеинов |
| Место образования | Эпителий тонкого кишечника | Клетки печени | Кровь | Кровь | Клетки печени, ЛПВП-предшественники |
| Плотность, г/мл | 0,92-0,98 | 0,96-1,00 | – | 1,00-1,06 | 1,06-1,21 |
| Диаметр частиц, нМ | Больше 120 | 30-100 | – | 21-100 | 7-15 |
| Основные аполипопротеины | В 48,С 2, Е | В-100, С 2, Е | В-100, Е | В-100 | А-1, С-2, Е |
Функции апопротеинов следующие: В-48 – основной белок хиломикронов; В-100–основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействующий с рецепторами ЛПНП; С-2 – активатор ЛП-липазы, переносится с ЛПВП на ХМ и ЛПОНП в крови; Е – взаимодействует с рецепторами ЛПНП; А – активатор фермента лецитин-холестеринтрансферазы (ЛХАТ).
Липопротеины хорошо растворимы в крови, не слипаются, т. к. имеют небольшой размер и отрицательный заряд на поверхности. Некоторые липопротеины легко проникают через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам.
Хиломикроны, имеющие большие размеры, не могут преодолеть капилляры и поэтому сначала попадают в лимфатическую систему, а потом через главный грудной проток вливаются в кровь вместе с лимфой.
Металлопротеины
Сложные белки могут в качестве небелковой части могут содержать
металлы (такие, как медь, железо, магний, цинк, селен и др.). Объединение белковой части с металлом, как правило, происходит посредством коплексной связи, без каких либо специальных группировок атомов. К числу металлопротеинов относятся около сотни ферментов, например, полифенолоксидаза, цитохромоксидаза (содержат Cu), карбоангидраза, алкогольдегидрогеназа, карбоксипептидаза, ДНК-и РНК-полимеразы (содержат Zn), цитохромы, каталаза, пероксидаза содержат Fe. Важная функция металлопротеинов связана с транспортированием металлов и/или их накоплением. К транспортным белкам относится металлопротеин трансферрин. Он синтезируется в печени и способен связывать только окисленное железо. Поступающее в кровь железо окисляется с помощью феррооксидазы, являющейся медь-содержащим белком плазмы крови церулоплазмином. Одна молекула трансферрина может связать один или два иона Fe, но одновременно с анионом CO c образованием комплекса трансферрин-2. В норме трансферрин крови насыщен железом примерно на 33%.
Ферритин – олигомерный белок, состоящий из тяжелых и легких полипептидных цепей, составляющих 24 протомера. Это пример металлопротеина, депонирующего железо. Ферритин может находиться в нескольких изоформах в зависимости от разного набора протомеров. По своей архитертуре ферритин – полая сфера, внутри которой может содержаться от 3000 до 45000 ионов трехвалентного железа. Тяжелые цепи ферритина окисляют двухвалентное железо с образованием трехвалентного. Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезенке и костном мозге.
Инсулин – гормон, вырабатываемый β-клетками поджелудочной железы и синтезирующийся в виде неактивного предшественника – препроинсулина, в ходе последовательного протеолиза в конечном итоге расщепляется до инсулина и С-пептида. Инсулин и С-пептиды в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры (рис. 9.2).
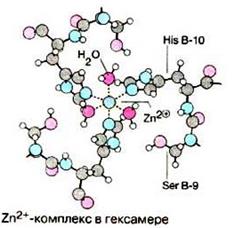
Рис.9.2. Гексамерный комплекс инсулина с Zn2+
Особое внимание необходимо уделить железо-серным белкам, содержащим негемовое железо. FeS-белки входят в состав электроннотранспортной цепи в комплекс I (содержащим кроме FMN не менее пяти железо-серных белков) и комплекс III, включающий один FeS-белок, цитохром с1 и две разные формы цитохрома b.
Атомы железа в FeS-белках собраны в несколько групп, т.н. железо-серных центров. Известны 3 типа FeS-центров – FeS, Fe2S2, Fe4S4, в которых атом железа связан с атомом серы остатков цистеина или неорганической серы (рис.9.3).
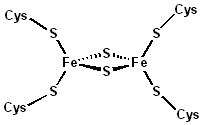
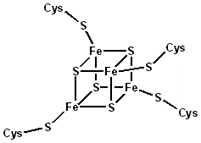
Рис.9.3. Железо-серные центы ферритина: Fe2S2-центр (слева), Fe4S4-центр (справа)
FeS-центр – атом железа связан координационными связями с четырьмя атомами серы, принадлежащими четырем остаткам цистеина в белке; Fe2S-центр ‒ каждый из двух атомов железа связан координационными связями с двумя атомами неорганической серы и двумя остатками цистеина в белке; Fe4S4-центр ‒ (четыре атома железа), каждый из четырёх атомов железа связан с четырьмя атомами серы и четырьмя остатками цистеина в белке.
ЛЕКЦИЯ 10






