Под теплоемкостью понимают количество тепла, необходимое для нагрева единицы количества вещества на 1 °С. Из этого определения следует, что
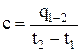 , (1.26)
, (1.26)
где t1 и t2 – начальная и конечная температура газов;
q1–2 – тепло, подведенное к единице количества газа в процессе его нагрева от t1 до t2.
В зависимости от единицы измерения количества вещества различают массовую 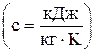 , объемную
, объемную 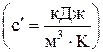 и мольную
и мольную  теплоемкость, между этими видами теплоемкости имеются простые связи:
теплоемкость, между этими видами теплоемкости имеются простые связи:
с = mс / m; с¢ = mc / 22,4; с¢ = rс. Зная величину теплоемкости, можно найти количество тепла, подведенное к телу или отведенное от него в каком-либо процессе 1 – 2:
q1–2 = с (t2 – t1). (1.27)
Нужно иметь в виду, что теплоемкость газов не является постоянной величиной. Она может принимать положительные и отрицательные значения, изменяясь в общем случае от +¥ до –¥.
Теплоемкость зависит прежде всего от способа подвода тепла, от характера процесса, в котором подводится пли отводится тепло. Действительно, анализируя выражение (1.26), можно заметить, что величина и знак теплоемкости определяются соотношением количества тепла q1-2 и изменением температуры рабочего тела в процессе 1 – 2. Как будет показано в дальнейшем, имеются процессы, в которых подвод тепла осуществляется без изменения температуры тела, т. е. t2 – t1 = 0. В этом случае теплоемкость становится равной бесконечности: с = ¥. Следовательно, сколько бы тепла ни подводилось, температура газа не повысится.
Возможны процессы, в которых температура тела изменяется без подвода тепла, т. е. при q1–2 = 0 теплоемкость с = 0.
Далее, если подводить тепло к 1 кг газа, находящегося в замкнутом объеме, то оно пойдет на увеличение его температуры и, следовательно, внутренней энергии. Если то же количество тепла подвести к 1 кг газа, имеющего возможность расширяться (например, в цилиндре с поршнем), то оно будет затрачено не только на возрастание внутренней энергии, но и на совершение работы против сил внешнего давления среды. Значит, прирост температуры в этом случае будет меньше, а теплоемкость – больше. Считая в первом процессе объем газа постоянным v = const, а во втором случае р = const, можно записать, что cР > cv.
С другой стороны, теплоемкость зависит от температуры газа. В общем случае эта зависимость определяется полиномом n-й степени:
c = a + bt + et2 +..., (1.28)
где а, b, е – постоянные для данного газа коэффициенты.
Зависимость c = f(t) представлена на рис. 1.2. Теплоемкость, определенная из уравнения (1.26), является некоторой средней теплоемкостью сm в интервале температур t1 ÷ t2. При уменьшении этого интервала до бесконечно малого значения dt получаем истинное значение теплоемкости в каждой точке
процесса:
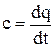 . (1.29)
. (1.29)
Количество тепла в процессе 1 – 2 через истинную теплоемкость выразится как
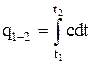 . (1.30)
. (1.30)
На рис. 1.2 найденное количество тепла представлено заштрихованной площадью. Это же тепло можно выразить через среднюю теплоемкость cm:
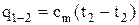 . (1.31)
. (1.31)
 В практических расчетах пользуются таблицами средних теплоемкостей, которые приводятся в интервалах температур от 0 °С до t °С, т. е.
В практических расчетах пользуются таблицами средних теплоемкостей, которые приводятся в интервалах температур от 0 °С до t °С, т. е. 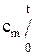 . Количество тепла q1-2 (согласно рис.1.2) может быть представлено в виде:
. Количество тепла q1-2 (согласно рис.1.2) может быть представлено в виде:
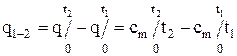 . (1.32)
. (1.32)






