Современная физика рассматривает атомы как частицы, состоящие из положительно заряженных ядер, окруженных электронными оболочками. Электроны относятся к категории микрочастиц, которым присущ принцип дуализма, то есть они обладают как свойствами частицы, так и свойствами волны. Ни видеть, ни осязать электроны нельзя. Поэтому, изучая их, приходится пользоваться моделями и абстракциями. Простейшей, наиболее наглядной моделью, является модель Н. Бора, в которой электроны уподобляются шарикам, вращающимся вокруг ядра по определенным орбитам. С точки зрения квантовой физики такое представление ошибочно, так как микрочастица не может одновременно обладать определенными значениями координаты и импульса. Поэтому применительно к микрочастице понятие траектории теряет смысл. Квантовая механика в состоянии предсказать лишь вероятность нахождения электрона в данной точке пространства. Эта вероятность представляет собой «усредненную» картину поведения электрона, что позволяет представить электрон в виде облака, которое называют орбиталъю.
Если в атоме водорода, удаляясь от ядра, проследить вероятность нахождения электрона, то окажется, что у самого ядра она равна нулю, потом возрастает, достигая максимального значения на расстоянии 0,53-10-8 см от ядра, а затем постепенно убывает. Расстояние r = 0,53-10-8 см условно принимают за радиус орбиты в атоме водорода, а сам электрон рассматривают в виде шарика массой т = 9,1-10-31 кг и зарядом q - 1,6-10-19 Кл. Количество вращающихся вокруг ядра электронов определяется порядковым номером химического элемента в периодической системе Д. И. Менделеева; в атоме водорода — один электрон, в атоме гелия — два и т. д.
Движение электронов вокруг ядра происходит по строго определенным орбитам так, что на длине орбиты укладывается целое число длин волн, называемых волнами Де Бройля. При этом условии на длине орбиты образуется стоячая волна и не происходит излучения электромагнитной энергии. В противном случае электрон будет терять свою энергию, радиус орбиты станет уменьшаться и в результате электрон окажется притянутым к ядру.
Длину волны можно определить, приравняв выражения для импульсов (количества движения) электрона, исходя из его волновой и корпускулярной природы:
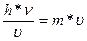
где h — постоянная Планка (h = 6,62-10-34 эВ*с);
ν — частота электромагнитных колебаний;
υ— скорость движения электрона по орбите.
Учитывая, что v =υ/λ, получаем формулу для длины волны:
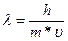 (1.1)
(1.1)
Для получения стоячей волны должно выполняться условие:
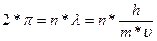 (1.2)
(1.2)
где г— радиус орбиты; п= 1, 2, 3,...
Возможные радиусы круговых орбит электрона в атоме водорода можно определить исходя из того, что центробежная сила уравновешивается силой кулоновского притяжения электрона к ядру:
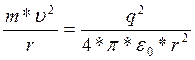
где εо= 8,85-10-12 Ф/м. Откуда получаем
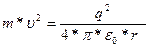 (1.3)
(1.3)
Значение тυ2 найдем из (1.2), подставим его в уравнение (1.3), из которого получим уравнение для возможных радиусов круговых орбит в атоме водорода:
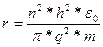 (1.4)
(1.4)
При n = 1 получаем r = 0,53*10 -8 см.
Находясь на какой-либо орбите, электрон обладает энергией, складывающейся из кинетической энергии движения электрона по орбите Еки потенциальной энергии притяжения электрона к ядру En. Для атома водорода
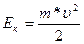 (1.5)
(1.5)
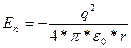 (1.6)
(1.6)
Подставляя в (1.5) уравнение (1.3), получаем:
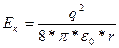 (1.7)
(1.7)
Полная энергия электрона
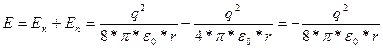 (1.8)
(1.8)
Подставляя (1.4) в (1.8), получаем:
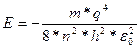 (1.9)
(1.9)
Подставив значения m, q, h и ε0, получим:
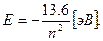
В начальном (невозбужденном) состоянии электрон в атоме водорода находится на наиболее близкой к ядру орбите и обладает энергией Е = -13,6 эВ. Путем внешнего энергетического воздействия он может быть переведен на более удаленную орбиту. Такое состояние атома называется возбужденным, оно является неустойчивым. В любом атоме электроны стремятся занять наиболее низкие энергетические уровни, поэтому спустя некоторое время электрон вернется на первоначальную орбиту, выделив при этом квант энергии, равный разности соответствующих энергетических уровней.
В многоэлектронных атомах потенциальная энергия электрона зависит не только от его расстояния до ядра, но и от расстояний до каждого из остальных электронов, вследствие чего численные значения радиусов орбит и, соответственно, величины энергии не совпадают с численными значениями радиусов и энергии для атома водорода. Вращение электронов в этих атомах может происходить как по круговым, так и по эллиптическим орбитам. Движение электрона по круговой орбите соответствует сферическому электронному облаку, а движение по эллиптической орбите — облаку в форме гантели. При этом электроны стремятся занять наиболее низкие энергетические уровни, но при условии, что на каждом энергетическом уровне находится не более двух электронов (принцип Паули). Чем больше электронов в атоме, тем более высокие энергетические уровни они занимают. Возможные энергетические состояния электронов характеризуют четырьмя квантовыми числами.
Главное квантовое число п определяет радиус круговой орбиты или большую полуось эллиптической. Оно может принимать значение п = 1, 2, 3 и т. д. Чем больше п, тем больше радиус орбиты и энергия электрона. Состояния электрона, определяемые главным квантовым числом, называют энергетическими уровнями.
Орбитальное квантовое число lопределяет малую полуось эллиптической орбиты. Оно может принимать значения l = 0,1,2,..., (n-1). Значение l = 0 соответствует круговой орбите. Энергетические состояния, характеризующиеся различными значениями l, называют подуровнями. Значению l = 0 соответствует s-подуровень, значению l = 1 — р-подуровень, значению l = 2— d-подуровень, значению l = 3 — f-подуровень.
Магнитное квантовое число т определяет пространственную ориентацию эллиптической орбиты. Оно может принимать значения т = 0, ±1, ±2,..., ±l. Каждому квантовому числу l соответствует (2 *l + 1) по-разному ориентированных орбит. При l = 1 возможны три взаимно-перпендикулярных р-орбиты; орбитальному квантовому числу l = 2 соответствует пять возможных пространственных ориентации орбит, называемых d-орбитами; квантовому числу l = 3 соответствует семь f-орбит.
Спиновое квантовое число s определяет момент количества движения электрона вокруг собственной оси. Вектор момента количества движения может быть параллелен или антипараллелен вектору орбитального момента. Спин электрона равен половине постоянной Планка, поэтому он равен +0,5 или -0,5.
Определим число возможных энергетических состояний на любом из энергетических уровней. На первом энергетическом уровне (п = 1) могут разместиться два электрона с противоположными спинами, что можно записать в виде 1s2, где 1 — номер энергетического уровня, s — состояние электрона на этом уровне, 2 — количество электронов в данном состоянии. На втором энергетическом уровне (п = 2) в s-состоянии могут находиться два электрона (2s2), в р-состоянии — шесть электронов (2р6). На третьем энергетическом уровне (п = 3) в s-состоянии могут находиться два электрона (3s2), в р-состоянии — шесть электронов (Зр6), в d-состоянии — десять электронов (3d10) и т. д.
При рассмотрении структуры электронных оболочек конкретных атомов следует руководствоваться двумя принципами:
◙ в атоме не может быть двух электронов с одинаковой комбинацией квантовых чисел;
◙ в нормальном (невозбужденном) состоянии электроны занимают квантовые состояния с наименьшей энергией.
Проследим, как заполняются электронные оболочки атомов по мере роста порядкового номера химического элемента в периодической таблице Д. И. Менделеева. В атоме водорода имеется один электрон на орбите 1s с произвольной ориентацией спина. Его энергетическое состояние может быть записано так: 1s1. В атоме гелия имеется два электрона с противоположными спинами. Его энергетическое состояние может быть записано так: 1s2. В атоме лития первая оболочка полностью заполнена электронами, поэтому третий электрон располагается на уровне 2s, в результате получается электронная конфигурация 1s22s'. У бериллия структура оболочки имеет вид 1s22s2. У бора пятый электрон занимает состояние 2р, и структура принимает вид 1s22s22p1. У последующих элементов происходит дальнейшее заполнение состояния 2р. У неона все возможные состояния 2р полностью заняты, и структура принимает вид ls22s22p6. Аналогичным образом происходит заполнение электронных оболочек третьего периода периодической таблицы. Структура оболочек аргона, завершающего этот период, имеет вид Is22s22p63s23pfi. После заполнения уровня Зр6 электроны сначала заполняют состояние 4s, так как энергетический подуровень 4s расположен ниже подуровня 3d, а затем состояния 3d и 4р. Правило заполнения оболочек можно записать в таком виде:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2.
Атомы элементов каждой группы периодической таблицы имеют одинаковое строение внешних и достраивающихся подуровней. Это наглядно видно на примере элементов четвертой группы:
◙ углерод (С) - 1s22s22p2;
◙ кремний (Si) - 1s22s22p63s23p2;
◙ германий (Ge) - 1s22s22p63s23p4s23d104p2.
Периодическая повторяемость структуры внешних электронных оболочек обусловливает периодическую повторяемость химических свойств элементов. Так, например, кремний и германий качественно обладают одинаковыми свойствами, различие состоит лишь в количественной оценке этих свойств.






