169. Какой объем печных газов (25°С, 760 мм. рт. ст.), содержащих 10 % сернистого газа (оксид серы (IV)), получается при обжиге 1 т серного колчедана, содержащего 45 % серы, если при этом 1,6 % серы не сгорает?
170. При прокаливании доломита CaCO3∙MgCO3 образуется углекислый газ. Рассчитать объем углекислого газа, если процесс протекает при температуре 227°С и давлении 1,4 атм.
171. При действии воды на карбид кальция образовалось 50 л ацетилена, измеренных при температуре 17°С и давлении 1,5 атм. Какова масса полученного ацетилена?
172. При обжиге известняка образуются негашеная известь (СаО) и углекислый газ. Сколько известняка, содержащего 92 % карбоната кальция, потребуется для получения 112 л углекислого газа, измеренного при температуре 127°С и давлении 11 атм.?
173. Для производства серной кислоты взяли 224 л сернистого газа, измеренного при температуре 37°С и давлении 1,8 атм. Сколько серной кислоты при этом получится, если выход готового продукта составляет 80 % от теоретического?
174. При коррозии железа выделилось 0,422 л водорода, измеренного при 7°С и давлении 741 мм рт. ст. определить, какое количество железа прокорродировало, если первоначально образуется соединение железа (II).
175. Какой объем углекислого газа необходимо отвести из печи при обжиге 1 т кальцита СаСО3 при 800°С и давлении 800 мм рт. ст?
176. Какой объем сернистого газа может быть получен при обжиге 1 т хвостов флотации сульфидных руд, содержащих 70 % пирита, если газ собирают в емкости под давлением 2 атм. при температуре 30°С? Реакция обжига пирита: 4 FeS2 + 11 O2 ® 2 Fe2O3 + 8 SO2.
177. Сульфид натрия получают в промышленности по реакции: Na2SO4 + 2 C® Na2S + +2 CO2. Какой объем углекислого газа следует отвести из печи при получении 1 т сульфида натрия с содержанием чистого вещества 68 % при 1200°С и давлении 820 мм рт. ст.?
178. Горячий KOH реагирует с хлором по реакции: 6 KOH + 3 Cl2 ® 5 KCl + KClO3 + 3 H2O. Сколько KOH потребуется для взаимодействия с 0,8 л хлора (7°С и 98,64 кПа)?
179. При прокаливании пирита (FeS2) массой 20 т был получен оксид серы (IV) объемом 7000 м3 (н.у.). Определить чистоту пирита и объем воздуха, необходимый для обжига пирита?
180. Сколько граммов кальция вступило в реакцию с водой, если объем выделившегося водорода при 25°С и 99,3 кПа равен 480 мл?
181. 10 г порошка латуни (сплав меди с цинком) обработали избытком соляной кислоты и получили 1,3 л водорода, измеренного при 18°С и 90000 Па. Каков процентный состав сплава?
182. В электрической печи из 20 кг технического оксида кальция было получено 16 кг карбида кальция по реакции: СаО + 3 С = СаС2 + СО. Определить массовую долю примесей в оксиде кальция и теоретический объем СО при температуре 546°С и давлении 101,3 кПа, а также массу необходимого углерода.
183. Для очистки типографского шрифта от вредных примесей цинка в его расплав добавляют хлорид аммония, который реагирует с находящимся в сплаве цинком. Уравнение этой реакции: 2 NH4Cl + Zn → ZnCl2 + 2 NH3 + H2. Образующийся хлорид цинка всплывает на поверхность расплава в виде шлака. Хлорид аммония добавляют в расплав из расчета 2,5 кг на 1 кг цинка. Соответствует ли это количество NH4Cl теоретическому?
184. 100 г почвы обработали соляной кислотой. При этом получили 500 мл углекислого газа, измеренного при 25°С и 1 атм. Определить процентное содержание карбонатов в почве.
185. Хлороводород, образовавшийся при действии серной кислоты на 19 г безводного хлорида магния, пропустили в раствор, содержащий 10 г гидроксида калия. Раствор выпарили. Какое вещество, и в каком количестве при этом получилось?
186. При действии на 5,1 г плотного известняка избытком соляной кислоты выделилось 1,12 л СО2 (н.у.). Сколько процентов карбоната кальция содержится в данном известняке?
187. Для получения оксида магния из металлического магния потребовалось 5 л воздуха, измеренных при температуре 27°С и давлении 1,3 атм. В воздухе содержится 21 % кислорода. Сколько оксида магния можно при этом получить?
188. Навеску 9,13 г магнезита обработали избытком азотной кислоты. Выделившийся газ поглотили раствором гидроксида натрия. Масса раствора щелочи после поглощения ею газа увеличилась на 4,4 г. Определите процентное содержание карбоната магния в магнезите.
189. Составить уравнение реакции горения сероуглерода и вычислить измеренный при 100°С и 780 мм рт. ст. объем газообразных продуктов, которые получаются сжиганием 25 г CS2.
190. Вычислить объем кислорода, полученный при разложении 15 г бертолетовой соли KClO3 при 25°С и 1 атм.
191. 50 г чистого металлического порошка цинка внесли в раствор комплексной соли золота K[Au(CN)2] при перемешивании раствора. Вес металлического осадка после опыта составил 69,7 г. Сколько граммов цинка перешло в раствор и каково содержание золота в осадке?
192. Какая масса известняка, содержащего 90 % карбоната кальция, потребуется для получения 7 т негашеной извести (СаО)?
193. Какое вещество, и в каком количестве останется в избытке после смешения растворов, содержащих 15 г хлорида бария и 11 г сульфата натрия?
194. Смешаны два раствора, содержащие 8,55 г нитрата свинца (II) и 3,75 г соляной кислоты. Какое вещество, и в каком количества останется в избытке?
195. Какое вещество, и в каком количестве останется в избытке в результате реакции между 14 г оксида кальция и 32 г азотной кислоты?
196. Какое вещество, и в каком количестве останется в избытке в результате реакции между 4 г оксида магния и 10 г серной кислоты?
197. Смешаны растворы, содержащие 17 г нитрата серебра и 15,9 г хлорида кальция. Какое вещество, и в каком количестве останется в избытке?
5. Растворы
Концентрации растворов
Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных пределах. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми.
В растворах выделяют растворитель и растворенное вещество. Растворителем называют компонент, который образует непрерывную среду. остальные компоненты, которые распределены в среде растворителя в виде дискретных частиц, называются растворенными веществами. Состав раствора (концентрация) чаще всего выражается следующими способами.
Массовая доля или процентное содержание w – соотношение масс растворенного m в вещества и раствора m р-р, выраженное в долях или процентах.
 . .
| (34) |
Концентрация, выраженная в граммах на литр, С г/л – показывает, какая масса растворенного вещества m в, выраженная в граммах, содержится в единице объема раствора V р-р:
 , г/л. , г/л.
| (35) |
Молярная концентрация или молярность, СМ – число молей растворенного вещества n в в одном дм3 (л) раствора:
 , моль/л. , моль/л.
| (36) |
Моляльная концентрация или моляльность, Сm – число молей растворенного вещества, приходящееся на один килограмм растворителя:
 , моль/кг. , моль/кг.
| (37) |
Мольная доля или мольные проценты xi – число молей компонента (растворителя или растворенного вещества) содержащееся в одном моле раствора:
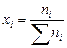 . .
| (38) |
5. Нормальная концентрация или нормальность, CN – количество эквивалентов, n эв растворенного вещества, содержащееся в одном литре раствора:
 , экв/л, , экв/л,
| (39) |
где z – количество обменных эквивалентов растворенного вещества, содержащееся в одном его моле.
Для кислот z соответствует основности кислоты, т. е. числу атомов водорода в составе кислоты, обмениваемых в данной реакции на металл или нейтрализуемых основанием.
Для оснований z соответствует кислотности основания, т.е. числу гидроксильных групп в составе основания, обмениваемых на кислотный остаток или нейтрализуемых кислотой.
Для солей z рассчитывают как произведение числа атомов и степени окисления металла в составе соли.
Для окислителей и восстановителей в окислительно-восстановительных реакциях z – изменение их степени окисления в ходе реакции.
Примеры решения задач
Пример 1. Раствор серной кислоты в воде с концентрацией 16 % (мас.) имеет плотность d = 1,109 г/см3. Выразить концентрацию этого раствора всеми способами.
Решение. 1. Выделим мысленно 1 кг раствора и найдем его объем: 
 .
.
2. Найдем массу растворенного вещества (H2SO4) по формуле (34): 
3. По формуле (35) вычислим концентрацию раствора серной кислоты в г/л: 
4. Найдем количество молей серной кислоты:

5. По формуле (36) вычислим молярную концентрацию раствора серной кислоты:

6. Найдем массу растворителя (Н2О):

7. По формуле (37) вычислим моляльную концентрацию раствора серной кислоты: 
8. Найдем количество молей воды:

9. По формуле (38) найдем мольную долю серной кислоты: 
10. По формуле (39) определим нормальную концентрацию раствора серной кислоты (для серной кислоты количество обменных эквивалентов в одном моле вещества z = 2):

Пример 2. Какой объем раствора серной кислоты концентрацией 10 % (d = 1,066 г/см3) требуется для приготовления 200 мл 1 н. раствора?
Решение. 1. найдем массу серной кислоты, содержащейся в 200 мл 1 н. раствора. Для этого вычислим молярную концентрацию раствора по формуле (39):  количество вещества серной кислоты по формуле (36)
количество вещества серной кислоты по формуле (36)
 и ее массу
и ее массу  .
.
2. Подставим найденную массу серной кислоты в уравнение (34) и вычислим объем 10 % раствора

Пример 3. Какой объем воды следует прибавить к 500 мл раствора, содержащего 40 г сульфата никеля, чтобы понизить его концентрацию до 0,05 моль/л?
Решение. 1. По уравнению (36) найдем объем 0,05 М раствора (V 2):  .
.
2. Найдем объем воды:  .
.
Пример 4. Найти молярную концентрацию раствора карбоната натрия, полученную при смешивании 600 мл 2,15 % раствора (d = 1,02 /см3) и 200 мл 8,82 % раствора (d = 1,09 г/см3).
Решение. 1. Найдем количество вещества карбоната натрия в каждом из смешиваемых растворов:

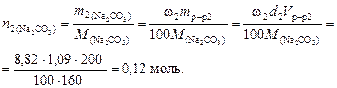
2. Вычислим молярную концентрацию полученного раствора: 
Пример 5. Какой объем раствора серной кислоты концентрацией 0,42 моль/л потребуется для нейтрализации 20 мл раствора гидроксида калия концентрацией 6 % (d = 1,053 г/см3)?
Решение. 1. Составим уравнение реакции:
2KOH + H2SO4 ® K2SO4 + 2H2O
2. По уравнению (34) найдем количество вещества KOH

3. По уравнению реакции на 2 моль KOH приходится 1 моль Н2SO4, следовательно, для реакции с 0,02 моль гидроксида калия требуется 0,01 моль серной кислоты.
4. По уравнению (36) найдем объем раствора серной кислоты: 
Задачи для решения
1. Выразить концентрацию заданного раствора всеми возможными способами.
| 1. | Al2(SO4)3 | 0,15 экв/л | 1,009 |
| 2. | AlCl3 | 0,55 % | 1,007 |
| 3. | Al(NO3)3 | 5,47 г/л | 1,01 |
| 4. | AlCl3 | 0,041 моль/кг | 1,007 |
| 5. | Al2(SO4)3 | 0,9 %(масс.) | 1,009 |
| 6. | Al(NO3)3 | 1,05 % (масс.) | 1,01 |
| 7. | BaCl2 | 1,69 моль/л | 1,28 |
| 8. | BaCl2 | 10 % | 1,092 |
| 9. | Ba(NO3)2 | 3,38 экв/л | 1,28 |
| 10. | Ba(NO3)2 | 0,525 моль/л | 1,092 |
| 11. | CaCl2 | 22 % | 1,203 |
| 12. | CaCl2 | 2,31 моль/л | 1,201 |
| 13. | Ca(NO3)2 | 2% | 1,01 |
| 14. | CdCl2 | 0,5 моль/л | 1,08 |
| 15. | Cd(NO3)2 | 0,5 экв/л | 1,04 |
| 16. | CrCl3 | 0,6 экв/л | 1,022 |
| 17. | Cr2(SO4)3 | 0,3 моль/л | 1,021 |
| 18. | Cr(NO3)3 | 3% | 1,02 |
| 19. | CuSO4 | 1,037 моль/кг | 1,206 |
| 20. | CuCl2 | 0,04 моль/л | 1,009 |
| 21. | Cu(NO3)2 | 1,037 экв/л | 1,20 |
| 22. | FeCl3 | 1,9 моль/л | 1,234 |
| 23. | FeSO4 | 0,3 экв/л | 1,02 |
| 24. | Fe2(SO4)3 | 0,3 моль/л | 1,03 |
| 25. | Fe(NO3)3 | 0,3 % | 1,0 |
| 26. | H2SO4 | 15 % | 1,1 |
| 27. | H2SO4 | 1,56 моль/л | 1,095 |
| 28. | H2SO4 | 3,4 мол. % | 1,109 |
| 29. | H2SO4 | 5,9 мол. % | 1,18 |
| 30. | H2SO4 | 30 % | 1,218 |
| 31. | H2SO4 | 40 % | 1,303 |
| 32. | H2SO4 | 20 % | 1,139 |
| 33. | H3PO4 | 2,79 моль/л | 1,115 |
| 34. | H3PO4 | 7,3 мол. % | 1,181 |
| 35. | H3PO4 | 30 % | 1,181 |
| 36. | H3PO4 | 855 г/л | 1,426 |
| 37. | H3PO4 | 3 мол. % | 1,08 |
| 38. | H3PO4 | 24 % | 1,14 |
| 39. | HCl | 0,4 мол. % | 1,002 |
| 40. | HCl | 1,17 моль/кг | 1,05 |
| 41. | HCl | 2% | 1,01 |
| 42. | HCl | 10 % | 1,047 |
| 43. | HCl | 17,4 мол. % | 1,149 |
| 44. | Hg(NO3)2 | 0,25 моль/л | 1,174 |
| 45. | HNO3 | 10,4 экв/л | 1,31 |
| 46. | HNO3 | 10,4 моль/л | 1,31 |
| 47. | HNO3 | 5,1 % | 1,03 |
| 48. | HNO3 | 1,64 моль/кг | 1,02 |
| 49. | HNO3 | 6 г/л | 1,01 |
| 50. | K2Cr2O7 | 0,18 моль/кг | 1,033 |
| 51. | KMnO4 | 0,25 экв/л | 1,027 |
| 52. | KOH | 3 мол. % | 1,073 |
| 53. | KOH | 34 % | 1,336 |
| 54. | KOH | 6,3 мол. % | 1,147 |
| 55. | KOH | 8,107 экв/л | 1,336 |
| 56. | KOH | 560 г/л | 1,411 |
| 57. | KOH | 0,12 моль/кг | 1,0 |
| 58. | MgSO4 | 20 % | 1,219 |
| 59. | MgCl2 | 2 % | 1,02 |
| 60. | Mg(NO3)2 | 0,05 моль/л | 1,01 |
| 61. | MnCl2 | 10 % | 1,086 |
| 62. | MnSO4 | 1 % | 1,0 |
| 63. | Na2CO3 | 0,39 моль/л | 1,019 |
| 64. | Na2CO3 | 4,1 % | 1,019 |
| 65. | Na2CO3 | 41,34 г/л | 1,019 |
| 66. | NaBr | 5,8 мол. % | 1,21 |
| 67. | NaBr | 26 % | 1,21 |
| 68. | NaCl | 7,1 мол. % | 1,147 |
| 69. | NaCl | 15 % | 1,109 |
| 70. | NaCl | 4,5% | 1,03 |
| 71. | NaOH | 13 % | 1,142 |
| 72. | NaOH | 1,3 % | 1,042 |
| 73. | NaOH | 3,7 моль/кг | 1,142 |
| 74. | NaOH | 1,48 г/л | 1,0 |
| 75. | NaOH | 0,37 экв/л | 1,142 |
| 76. | NH4OH | 10 % | 0,957 |
| 77. | NH4OH, | 9 % | 0,961 |
| 78. | Pb(NO3)2 | 30 % | 1,328 |
| 79. | ZnSO4 | 1,374 экв/л | 1,107 |
| 80. | ZnSO4 | 87 г/л | 1,084 |
Задачи на приготовление раствора
1. Какой объем 88 % раствора серной кислоты плотностью 1,8 г/см3 надо взять, чтобы приготовить 2 л этой же кислоты концентрацией 2,36 моль/л?
2. Требуется приготовить 500 мл 15 % раствора едкого кали плотностью 1,14 г/см3. Какое количество миллилитров 12-ти нормального раствора едкого кали (КОН) надо для этого взять?
3. Какое количество воды надо добавить к 200 мл 52 % раствора едкого натра, плотность которого 1,35 г/см3, чтобы получить раствор с концентрацией 2,78 моль/л?
4. Раствор серной кислоты концентрацией 3 моль/л имеет плотность 1,18 г/см3. Какое количество воды надо прилить к 118 г этого раствора, чтобы получить раствор с концентрацией 12 %?
5. Сколько воды надо добавить к 125 мл 26 % раствора соляной кислоты плотностью 1,13 г/см3, чтобы получить раствор с концентрацией 14,5 %?
6. Какое количество воды надо добавить к 150 г раствора хлорида бария в воде, концентрация которого 2 экв/л, а плотность 1,2 г/см3, с тем, чтобы получить раствор с концентрацией 8 %?
7. Какое количество миллилитров раствора фосфорной кислоты, мольная доля которого 0,01 (плотность раствора 1,025 г/см3) надо взять, чтобы получить 200 г раствора с концентрацией 2,6 %?
8. Сколько миллилитров 2,25 М раствора хлорида калия надо взять, чтобы приготовить 1,5 л 6 % раствора, плотностью 1,04 г/см3?
9. Какой объем 38 % раствора соляной кислоты плотностью 1,189 г/см3 потребуется для приготовления 250 мл 0,08 н. раствора?
10. Сколько миллилитров 96 % раствора серной кислоты плотностью 1,84 г/см3 потребуется для приготовления 2 л 0,25 н. раствора?
11. Сколько граммов едкого кали надо взять для приготовления двух литров 10 % раствора плотностью 1,09 г/см3?
12. Сколько миллилитров 98 % раствора серной кислоты плотностью 1,837 г/см3 надо взять для приготовления 500 мл 0,1 н. раствора?
13. Сколько миллилитров 3 н. раствора фосфорной кислоты надо взять для приготовления 1 л 0,5 М раствора?
14. Как приготовить 500 мл 0,5 н. раствора соды из 2 н. ее раствора?
15. Сколько миллилитров воды надо прибавить к 300 мл 25 % раствора едкого кали, плотностью 1,236 г/см3, чтобы получить 8 % раствор?
16. Сколько миллилитров 56 % азотной кислоты плотностью 1,345 г/см3 потребуется для приготовления 1 литра 0,1 М раствора?
17. Сколько миллилитров воды надо прибавить к 100 мл 48 % раствора серной кислоты плотностью 1,376 г/см3, чтобы получить 0,5 н. раствор?
18. До какого объема надо разбавить 200 мл 1 н. раствора хлорида натрия, чтобы получить 4,5 % раствор плотностью 1,029 г/см3?
19. Сколько граммов сульфата натрия надо прибавить к 1 л 10 % раствора плотностью 1,09 г/см3, чтобы получить 15 % раствор?
20. Сколько воды надо прибавить к 200 мл 32 % раствора азотной кислоты плотностью 1,193 г/см3 чтобы получить 10 % раствор?
21. Сколько 36 % раствора соляной кислоты плотностью 1,179 г/см3 потребуется для приготовления 1 л 0,5 н. раствора?
22. Сколько воды надо добавить к 50 мл 2 н. раствора, чтобы получить 0,25 н. раствор?
23. Сколько граммов хлорида аммония надо добавить к 5 л 2,1 М раствора плотностью 1,054 г/см3 чтобы получить 20 % раствор?
24. Сколько граммов едкого натра надо взять для приготовления двух литров 10 % раствора плотностью 1,080 г/см3?
25. Как приготовить один литр 1 н. раствора KOH из 49 % раствора той же щелочи плотностью 1,5 г/см3?
26. Имеется 80 % раствор серной кислоты плотностью 1,732 г/см3. Как из него приготовить 2 л 6 М раствора H2SO4?
27. Сколько 60 % серной кислоты плотностью 1,503 г/см3 надо взять для приготовления 10 литров 0,1 н. ее раствора?
28. Сколько воды надо испарить, чтобы из 10 л 0,25 М раствора ортофосфорной кислоты получить 6 М раствор?
29. В лаборатории имеется 20 кг 12 % раствора поташа K2CO3. Сколько килограммов технического поташа, содержащего 8 % посторонних примесей надо взять для повышения концентрации имеющегося раствора до 20 %?
30. Какой объем 10 % раствора карбоната натрия плотностью 1,105 г/см3 требуется для приготовления 5 л 2 % раствора плотностью 1,02 г/см3?
31. Сколько граммов хлористого аммония потребуется для приготовления 600 мл 0,5 М раствора?
32. Какую массу нитрата свинца (II) надо взять для приготовления 300 мл 0,2 н. раствора?
33. Сколько граммов медного купороса (пентагидрата сульфата меди (II)) надо взять для приготовления одного литра 2 н. раствора?
34. Какой процентной концентрации получится соляная кислота, если к 100 мл раствора HCl 36 % и плотностью 1,179 г/см3 прибавить 200 мл воды?
35. Сколько граммов азотной кислоты содержится в 1 л 36 % раствора плотностью 1,221 г/см3?
36. Какой процентной концентрации получится раствор, если к 500 мл 30 % раствора КОН плотностью 1,288 г/см3 прибавить 500 мл воды?
37. Какой объем аммиака следует растворить в воде при 25°С и 120 кПа для получения 2 л 10 % раствора гидроксида аммония, плотностью 0,96 г/см3?
38. Какая масса сульфита натрия потребуется для приготовления 5 л 8 % раствора плотностью 1,075 г/см3?
39. Сколько воды надо прибавить к 50 мл 2 н. раствора, чтобы получить 0,25 н. раствор?
40. Какой объем воды потребуется для растворения 67,2 л хлороводорода (н.у.) для получения 9 % раствора (плотность 1,04 г/мл)?
41. Сколько грамм десятиводного сульфата натрия нужно растворить в 800 мл воды для получения раствора с концентрацией по безводному сульфату натрия 10 %?
42. Какая масса хлорида калия потребуется для приготовления 200 мл раствора с концентрацией 1,455 моль/л?
43. Необходимо приготовить 100 г раствора хлорида бария с концентрацией 5 %. Какая масса дигидрата хлорида бария потребуется для этого?
44. Какой объем 30 % раствора серной кислоты (плотность 1,12 г/см3) потребуется для приготовления 2 л раствора концентрацией 0,4 н.?
45. Какой объем аммиака при температуре 25°С и давлении 1 атм. следует растворить в 1 л воды для получения раствора гидроксида аммония концентрацией 20 %?
46. Рассчитать, какой объем воды следует взять для растворения 16 г СН3ОН для получения раствора метанола с мольной долей 0,02
47. Раствор хлорида алюминия в воде имеет концентрацию 2 экв/л и плотность 1,08 г/см3. К 50 г этого раствора добавили 35 мл воды и его плотность стала 1,035 г/см3. Найти массовую долю хлорида алюминия в новом растворе.
48. Сколько 5 % раствора можно приготовить из 1 т плавленого сульфида натрия, содержащего 30 % примесей?
49. Раствор хлорида алюминия в воде имеет концентрацию 2,18 экв/л и плотность 1,08 г/см3. К 50 г этого раствора добавили 35 мл воды и его плотность стала 1,044 г/см3. Найти концентрацию нового раствора (%).
50. К 200 мл 0,7 н. раствора серной кислоты прибавили 300 г воды. Рассчитать конечную концентрацию серной кислоты (в г/л).






