 , следовательно, в искомой формуле содержится в 2 раза больше атомов каждого вида и ее формула S2F2.
, следовательно, в искомой формуле содержится в 2 раза больше атомов каждого вида и ее формула S2F2.
Пример 4. При окислении 2,81 г кадмия получено 3,21 г оксида кадмия. Вычислить эквивалентную массу кадмия и определить его валентность.
Решение. 1. По массе кадмия и массе его оксида найдем массу кислорода: m (O) = m (CdO) - m (Cd) = 3,21 - 2,81 = 0,4 г.
2. Образование оксида кадмия можно записать в виде схемы реакции Cd + O ® CdO, для которой составим пропорцию согласно закону эквивалентов (32):


3. Сравнивая численные значения эквивалентной массы и молярной массы кадмия, находим:  , следовательно, валентность кадмия равна 2.
, следовательно, валентность кадмия равна 2.
Пример 5. Оксид марганца (IV) при прокаливании теряет кислород, образуя Mn3O4. Какой объем кислорода при температуре 27°С и давлении 1,1 атм. выделится из 0,58 кг MnO2?
Решение. Запишем уравнение реакции разложения:
 ,
,
из которого следует, что 3 моль MnO2 дают 1 моль кислорода.
Найдем количество вещества MnO2



следовательно, образуется  .
.
2. Учитывая, что 1 атм. = 101325 Па, по уравнению Менделеева-Клапейрона (26) получим:

Пример 6. К раствору, содержащему 0,2 моль хлорного железа (FeCl3) прибавили 0,24 моль гидроксида натрия. Какое количество гидроксида железа при этом получилось?
Решение. 1. Составим уравнение реакции: FeCl3 + 3 NaOH ® Fe(OH)3 + 3 NaCl, из которого следует, что 1 моль FeCl3 взаимодействует с 3 моль NaOH, следовательно, для реакции с 0,2 моль хлорного железа требуется гидроксида натрия: 0,2×3 = 0,6 моль.
2. По условию задачи, количество вещества NaOH составляет 0,24 моль, т. е. он в недостатке. Дальнейший расчет ведем по гидроксиду натрия.
3. Составим пропорцию:
3 моль NaOH - 1 моль FeCl3
0,24 моль NaOH - х моль FeCl3,
из которой вычислим количество вещества гидроксида железа (III): 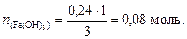
Задачи для решения
1. Состав минерала гематита выражается соотношением m (Fe): m (O) = 7:3. Сколько граммов железа можно получить из 50 г этого минерала?
2. В промышленном масштабе оксид кадмия получают сжиганием кадмия в избытке сухого воздуха. Определить количественный состав оксида кадмия и вывести его формулу, если при сжигании 2,1 г кадмия получается 2,4 г оксида.
3. Криолит имеет состав AlF3∙3NaF. Вычислить массовую долю фтористого алюминия в криолите.
4. Дать название соединения и рассчитать процентное содержание в нем хрома и оксида хрома (VI): K2Cr2O7.
5. Для анализа хлорида меди и определения его количественного состава в раствор, содержащий 0,4 г хлорида меди, влили раствор нитрата серебра. Образовался осадок хлорида серебра массой 0,849 г. Определить количественный состав и вывести формулу хлорида меди.
6. После предварительной очистки боксита был получен безводный продукт, состоящий в основном из оксида алюминия и содержащий 0,3 % оксида кремния (IV) и 0,048 % оксида железа (III). Каково процентное содержание кремния и железа в данном продукте?
7. Сколько марганца можно выделить методом алюмотермии из 20 кг пиролюзита, содержащего 87 % оксида марганца (IV)?
8. Дать химическое название минерала и рассчитать массовую долю хлора в карналлите KMnCl3∙6H2O.
9. Дать название соединения и рассчитать массовую долю никеля в (NiOH)2SO4.
10. Сколько концентрата с содержанием меди 60 % можно получить из 1 т руды, содержащей 3 % халькозина (Cu2S) и 2 % ковеллина (CuS)?
11. Дать химическое название минерала и рассчитать процентное содержание меди в хризоколле CuSiO3∙2H2O.
12. Какую массу железа можно получить из 2 т железной руды, содержащей 94 % Fe3O4.
13. Какую массу алюминия можно получить из одной тонны нефелина NaAlSiO4?
14. Составить формулу дигидроксосульфата железа (III) и рассчитать процентное содержание в нем оксида серы (VI).
15. KHSO4 можно представить себе как бы составленным из K2O и SO3. Найти процентное содержание оксида серы (VI) в этом соединении и назвать его.
16. Написать формулу сульфата железа (III) и рассчитать содержание железа в этом соединении.
17. Определить, сколько серебра и оксида серебра можно получить из 10 кг хлорида серебра.
18. Вычислить содержание оксида меди (II) и назвать соединение: (CuOH)2CO3.
19. Дать химическое название и рассчитать процентное содержание хлора в FeCl3·6H2O
20. Дать название соединения и рассчитать процентное содержание в нем никеля: (NiOH)3(PO4).
21. Вещество состоит из серы и углерода. Для определения его количественного состава взято 0,3045 г этого вещества. Вся сера, содержавшаяся во взятой пробе, переведена в сульфат бария, масса которого 1,867 г. Найти количественный состав вещества и вывести его формулу.
22. Вещество состоит из алюминия и хлора. Из некоторого количества вещества получено 1,7196 г AgCl и 0,2038 г Al2O3. Найти количественный состав и установить формулу вещества.
23. При восстановлении 2,4 г оксида меди водородом получено 0,54 г Н2О. Найти количественный состав и вывести формулу оксида.
24. Бертолетова соль при нагревании разлагается на кислород и хлорид калия. Вычислить количественный состав бертолетовой соли и вывести ее формулу, если при разложении 1,02 г ее получено 0,62 г KCl.
25. Вещество состоит из калия, серы и кислорода. Сера и кислород, содержавшиеся в 0,871 г этого вещества были выделены в виде BaSO4, который весил 1,167 г. Найти количественный состав и вывести формулу вещества.
26. Вещество состоит из меди, углерода, кислорода и водорода. При разложении некоторого количества его получено 1,432 г CuO, 0,396 г CO2 и 0,159 г воды. Найти количественный состав и вывести формулу вещества.
27. Вещество состоит из меди и серы. Из 0,667 г этого вещества получено 0,556 г CuO. Вычислить процентный состав и вывести формулу вещества.
28. К раствору 0,408 г хлорида меди прилили раствор нитрата серебра. Образовался осадок хлорида серебра массой 0,86 г. Вычислить количественный состав хлорида и вывести его формулу.
29. При анализе образца железной руды массой 125 г, в нем обнаружили 58 г магнетита Fe3O4. Вычислить массовую долю железа в образце руды.
30. Вывести истинную формулу соединения, содержащего 1,59 % водорода, 22,21 % азота и кислород. Молярная масса соединения составляет 63 г/моль.
31. Вывести истинную формулу соединения, содержащего 3,03 % водорода, 31,62 % фосфора и кислород. Молярная масса соединения составляет 80 г/моль.
32. Вывести истинную формулу соединения, содержащего 6,75 % водорода, 39,97 % углерода и кислород. Относительная плотность паров этого вещества по углекислому газу равна 4,091.
33. При сгорании 10,5 л органического вещества получили 16,8 л оксида углерода (IV) (н. у.) и 13,5 г воды. Плотность этого вещества составляет 1,875 г/см3. Вывести формулу данного вещества.
34. Определите химическую формулу вещества, в состав которого входят 5 массовых частей кальция и 3 массовых части углерода.
35. В состав вещества входят 32,8 % Na, 12,9 % Al, 54,3 % F. Вывести формулу вещества.
36. Вещество состоит из углерода, водорода, серы, ртути и хлора. Найти простейшую формулу этого вещества на основании следующих данных: а) при окислении 3,61 г вещества получено 1,72 г оксида углерода (IV) и 0,90 г воды; б) из 0,722 г вещества получено 0,467 г сульфата бария; в) из 1,0851 г вещества получено 0,859 г хлорида серебра.
37. При обжиге пирита выделяется газ, содержащий 40 % серы и 60 % кислорода и имеющий плотность по воздуху при н.у. 2,76. Вывести формулу газа.
38. Качественный анализ показал, что малахит состоит из меди, углерода, кислорода и водорода. При разложении некоторого количества малахита было получено 0,48 г оксида меди (II), 0,132 г оксида углерода (IV) и 0,053 г воды. Вывести формулу малахита.
39. Алюмокалиевые квасцы содержат 8,23 % калия, 5,7 % алюминия, 13,5 % серы, 27,0 % кислорода и 45,5 % воды. Вывести формулу квасцов.
40. При получении стали особенно нежелательны в ней примеси серы и фосфора. Фосфор в стали содержится в виде кислородного соединения, содержащего 43,66 % фосфора и 56,34 % кислорода. Плотность данного соединения по воздуху 4,9 (н.у.). Вывести формулу данного кислородного соединения фосфора.
41. На завод доставлена руда, содержащая 696 т магнитного железняка. Из этой руды выплавили 504 т железа. Вывести формулу магнитного железняка, если известно, что он состоит только из железа и кислорода.
42. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6 г соли при прокаливании теряют в массе 5,4 г.
43. Найти простейшую формулу вещества, содержащего (по массе) 43,4 % натрия, 11,3 % углерода и 45,3 % кислорода.
44. Вещество содержит (по массе) 40,21 % калия, 26,80 % хрома и 32,99 % кислорода. Найти его простейшую формулу.
45. Соединение содержит 46,15 % углерода. Остальное – азот. Плотность по воздуху равна 1,79. найти истинную формулу соединения.
46. При полном сжигании 2,66 г некоторого вещества получилось 1,54 г СО2 и 4,48 г SO2. Найти простейшую формулу вещества.
47. Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2 %.
48. Соединение серы с фтором содержит 62,8 % S и 37,2 % F. Масса 118 мл данного соединения в форме газа при 7°С и 98,64 кПа равна 0,51 г. Какова истинная формула соединения?
49. Найти формулу вещества, содержащего 85,71 % С и 14,29 % Н, если плотность этого газа по воздуху равна 4,83.
50. При полном сгорании органического вещества массой 13,8 г получили оксид углерода (IV) массой 26,4 г и воду массой 16,2 г. найти молекулярную формулу вещества, если плотность его пара по водороду 23.
51. Химическое соединение состоит из меди, серы, кислорода и воды. Содержание компонентов (%, мас.) соответственно равно 25,48; 12,82; 25,64 и 36,06. Найти формулу соединения и назвать его.
52. Установить формулу газообразного вещества, содержащего 20 % (мас.) водорода и 80 % (мас.) углерода, если его плотность по водороду равна 15.
53. При полном сгорании 0,23 г вещества, состоящего из углерода, водорода и кислорода, получилось 0,27 г воды и 224 мл углекислого газа, измеренного при н.у. Установите молекулярную формулу вещества, если плотность его пара по воздуху 1,59.
54. В состав соединения входят углерод, водород и азот. Углерод составляет в нем 79,12 %. Масса азота, полученного из 0,546 г равна 0,084 г. Молярная масса вещества равна 182. Вывести его формулу.
55. Установите формулу кристаллогидрата, содержащего 8,11 % Al, 28,83 % O, 14,41 % S, 48,65 % H2O.
56. Установите формулу вещества, содержащего 42,9 % SiO2 и 57,1 %MgO.
57. Установите формулу кристаллогидрата, содержащего 16,08 % Na, 4,2 % C, 16,78 % O, и 62,94 % H2O.
58. Установите формулу кристаллогидрата, содержащего 16,08 % Na, 11,94 % S, 23,89 % O, и 47 % H2O.
59. Вычислить молярную массу бензола, если 1,1 л его паров при 91°С и 81313 Па имеет массу 2,31 г.
60. Масса 584 мл газа при 21°С и нормальном давлении равна 1,44 г. Вычислить молярную массу газа.
61. Масса 0,36 л паров вещества при 98°С и 98,642 кПа равна 1,8 г. Вычислить молярную массу вещества.
62. Масса 454 мл газа при 44°С и 97309 Па равна 1,19 г. Вычислить молярную массу газа.
63. Вычислить массу 1 м3 воздуха при 37°С и 83200 Па.
64. Вычислить объем, который занимает при 27°С и 760 мм. рт. ст. 1 кг воздуха.
65. Баллон емкостью 20 л содержит 3 кг кислорода. Вычислить давление в баллоне при 20°С.
66. Вычислить, при каком давлении 5 кг азота займут объем 50 л, если температура равна 500°С?
67. Баллон емкостью 10 л при 27°С содержит 3×1023 молекул кислорода. Вычислить давление кислорода в баллоне.
68. колба емкостью 0,75 л, наполненная кислородом при 20°С, имеет массу 132 г, масса пустой колбы составляет 130,79 г. Вычислить давление кислорода в колбе.
69. Стальной баллон для хранения сжатых газов содержит 64 кг кислорода. Сколько будет весить углекислый газ, которым наполнен такой же баллон при тех же условиях?
70. Некоторый газ собрали в закрытый цилиндр объемом 41 л при температуре 627°С и давлении 1,2 атм. Масса газа, находящегося в цилиндре, оказалась равной 42,7 г. Найти молярную массу газа и определить, что это за газ, если он имеет в своем составе серу.
71. Для анализа газа отобрали пробу газа в колбу, емкостью 100 мл при 25°С и 779 мм. рт. ст. Масса колбы с газом оказалась равной 16,392 г, а масса пустой колбы – 16,124 г. Определить молярную массу газа.
72. Для определения состава газа колбу, емкостью 232 мл заполнили этим газом при температуре 17°С и давлении 752 мм. рт. ст. Масса колбы увеличилась на 0,27 г. Вычислить молярную массу газа.
73. Для анализа состава газа был наполнен газометр емкостью 20 л при давлении 1,025 атм. и температуре 17°С. Масса газометра увеличилась на 10 г. Вычислить молярную массу газа.
74. Газом наполнили цилиндр, емкостью 1 л при температуре 21°С и давлении 1,05 атм. Масса газа, находящегося в цилиндре, равна 1,48 г. Вычислить молярную массу газа.
75. Определить сколько молекул содержится в 3 л некоторого газа при давлении 1520 мм. рт. ст. и температуре 127°С.
76. Определить при какой температуре находится 0,2 г некоторого газа, занимающего объем 0,32 л, если давление газа 1,5 атм., а его плотность по воздуху 1,52.
77. Какова температура газа, если его давление составляет 30 атм., масса - 1,5 кг, объем 170 л, плотность по воздуху 1,08.
78. При давлении 98,7 кПа и температуре 91°С газ занимает объем 680 мл. Найти объем газа при н.у.
79. В баллоне находится газ при температуре 27°С. Какая часть газа останется, если при открытом баллоне повысить температуру газа на 100°С.
80. Давление газа в закрытом сосуде при 12°С равно 100 кПа. Каким станет давление газа, если нагреть сосуд до 303 К?
81. 0,111 г некоторого вещества заняли 26 мл при 17°С и 104 кПа. Вычислить молярную массу газа.
82. Даны 8 л газа при -23°С. При какой температуре объем газа станет равным 10 л, если давление оставить неизменным?
83. В закрытом баллоне емкостью 40 л находится 77 г СО2. Манометр, подключенный к баллону, показывает давление 106,6 кПа. Вычислить температуру газа в баллоне.
84. При 27°С объем газа равен 600 мл. Какой объем газ займет при увеличении температуры на 30 К, если давление оставить неизменным.
85. Найти массу 1 м3 воздуха при 17°С и давлении 624 мм рт. ст.
86. Газ при 10°С и давлении 960 гПа занимает объем 50 мл. при каком давлении газ будет занимать объем 10 мл, если его температура выросла на 10 К.
87. Определить молярную массу органического вещества, зная, что 0,39 г его паров при температуре 87°С и давлении 936 мм рт. ст занимают объем 120 мл.
88. Вычислить массу 3 м3 кислорода при температуре 27°С и давлении 780 мм рт. ст.
89. Вычислить массу кислорода, заполнившего газометр емкостью 14,5 л. при температуре 17°С и давлении 16 атм.
90. Определить молярную массу газа, 0,96 г которого занимают объем 0,41 л при температуре 27°С и давлении 1,2 атм.
91. Сосуд емкостью 5 л содержит 7 г азота при 273 К. Определить давление газа. При какой температуре оно станет равно 1 атм?
92. В сосуде емкостью 15 л находится 21 г азота при 400 К. Определить давление газа.
93. Сколько весит 1 л газа при н.у., если плотность его по воздуху 1,52?
94. В сосуде емкостью 15 л находится 21 г азота при 273 К. Определить давление газа.
95. Литр некоторого газа весит при н.у. 2,86 г. Определить молярную массу газа и его плотность по воздуху.
96. 2,8 л газа весят при н.у. 2 г. Определить молярную массу газа и его плотность по воздуху.
97. Определить массу 190 мл паров бензола при температуре 97°С и давлении 740 мм рт. ст.
98. Какой объем занимают 4,2 г азота при температуре 16°С и давлении 771 мм рт. ст.?
99. Вычислить молярную массу неизвестного газа и его плотность по воздуху, зная, что 0,5 л этого газа при н.у. весят 0,5804 г.
100. Определить молярную массу эфира, зная, что 312 мл его паров при температуре 47°С и давлении 800 мм рт. ст. весят 0,925 г.
101. Найти массу 1 л воздуха при температуре 40°С и давлении 939 мм рт. ст.
102. Определить молярную массу вещества, зная, что 312 мл его паров при температуре 40°С и давлении 939 мм рт. ст. весят 1,79 г.
103. 52,5 г азота занимают при температуре 7°С объем 41 л. определить давление газа.
104. Определить молярную массу газа, 0,96 г которого занимают объем 0,41 л при температуре 27°С и давлении 1,2 атм.
105. Вычислить массу кислорода, заполнившего газометр емкостью 14,5 л. при температуре 17°С и давлении 16 атм.
106. В закрытом сосуде емкостью 3 л смешаны 0,5 л азота и 2,5 л водорода. Их начальное давление равно 103,5 и 93,7 кПа соответственно. Определить парциальные давления газов и общее давление смеси.
107. Смешали 2 л углекислого газа ( = 1 атм.) и 5,6 л азота (
= 1 атм.) и 5,6 л азота ( = 96,9 кПа). Каковы парциальные давления газов в смеси и общее ее давление?
= 96,9 кПа). Каковы парциальные давления газов в смеси и общее ее давление?
108. Вычислить объемные доли (%) неона и аргона в смеси, если их парциальные давления составляют соответственно 203,4 и 24,6 кПа.
109. Вычислить объемные доли (%) оксидов углерода (II) и (IV), парциальные давления которых составляют соответственно 0,24 и 0,17 кПа.
110. Общее давление в смеси аргона и водорода составляет 108,6 кПа. Какова объемная доля аргона, если парциальное давление водорода составляет 105,2 кПа?
111. В сосуде емкостью 6 л находится азот под давлением 3×106 Па. После добавления кислорода давление смеси стало равным 3,4×106 Па. Какова объемная доля кислорода в смеси?
112. В газгольдере над водой при температуре 25°С находится 5,2 л кислорода под давлением 102,4 кПа. Каков объем сухого кислорода, если давление насыщенного водяного пара при той же температуре составляет 3,164 кПа?
113. В результате реакции 4,45 г металла с водородом образовалось 5,1 гидрида. Определить эквивалентную массу металла.
114. При взаимодействии 0,385 г металла с хлором образовалось 1,12 г хлорида этого металла. Вычислить эквивалентную массу данного металла.
115. Для реакции 0,44 г металла с бромом потребовалось 3,91 г брома. Определить эквивалентную массу металла.
116. Определить эквивалентную массу двухвалентного металла и назвать его, если для полного сгорания 3,2 г металла потребовалось 0,26 л кислорода, измеренных при нормальных условиях.
117. При пропускании сероводорода через раствор, содержащий 7,32 г хлорида двухвалентного металла, было получено 6,133 г его сульфида. Определить эквивалентную массу металла.
118. При разложении 4,932 г оксида металла получено 0,25 л кислорода (н. у.). Определить эквивалентную массу металла.
119. При взаимодействии пластинки металла массой 10,2 г с раствором сульфата меди (II) масса пластинки увеличилась на 1,41 г. Вычислить эквивалентную массу металла.
120. В оксиде свинца содержится 7,14 % (мас.) кислорода. Определить эквивалентную массу свинца.
121. соединение металла с галогеном содержит 64,5 % (масс.) галогена, оксид того же металла содержит 15,4 % (масс.) кислорода. Определить эквивалентную массу галогена и назвать его.
122. На восстановление 6,33 г оксида металла израсходовано 0,636 л водорода (н. у.). Определить эквивалентную массу металла.
123. 2 г некоторого металла соединяются с 1,39 г серы или с 6,95 г брома. Вычислить эквивалентную массу металла.
124. 0,321 г алюминия и 1,168 г цинка вытесняют из кислоты одинаковое количество водорода. Найти эквивалентную массу цинка, если эквивалентная масса алюминия равна 8,99 г/экв.
125. Сколько литров водорода (н. у.) потребуется для восстановления 112 г оксида металла, содержащего 71,43 % металла? Какова эквивалентная масса металла?
126. Вычислить молярную и эквивалентную массу двухвалентного металла, если 2,2 г его вытесняют из кислоты 0,81 л водорода при 22°С и 102,9 кПа. Определить металл.
127. Вычислить эквивалентную массу кислоты, если на нейтрализацию 0,234 г ее потребовалось 28,9 мл раствора гидроксида натрия концентрацией 0,1 моль/л.
128. На нейтрализацию 2 г основания потребовалось 3,04 г соляной кислоты. Вычислить эквивалентную массу основания.
129. Вычислить эквивалент ортофосфорной кислоты в следующих реакциях:
а) K2CO3 + 2 H3PO4 ® 2 KH2PO4 + CO2 + H2O
б) K2CO3 + H3PO4 ® K2HPO4 + CO2 + H2O
в) 3 K2CO3 + 2 H3PO4 ® 2 K3PO4 + 3CO2 + 3 H2O
130. Вычислить эквивалент карбоната калия в следующих реакциях:
а) K2CO3 + HI ® KHCO3 + KI
б) K2CO3 + 2 HI ® H2CO3 + 2 KI
131. В технике оксид меди получают прокаливанием меди при недостатке воздуха. Определить эквивалентную массу меди, если при прокаливании 8 г меди получается 9 г оксида меди.
132. Минерал халькозин (медный блеск) содержит 20 % серы. Определить эквивалентную массу метала и формулу халькозина.
133. Одним из способов получения металлов является восстановление их оксидов водородом. Рассчитать эквивалентную массу металла, если известно, что на восстановление 3,4 г оксида металла потребовалось столько водорода, сколько его выделяется при реакции 6,54 г цинка с кислотой.
134. Вычислить эквивалентную массу металла, если из 4,93 г хлорида металла по реакции с нитратом серебра получилось 8,61 г хлорида серебра.
135. В азотной кислоте растворили 0,58 г меди. Полученную соль прокалили, в результате получили 0,726 г оксида меди. Вычислить эквивалентную массу меди.
136. 1,02 г металла растворили в кислоте. При этом выделилось 0,94 л водорода, измеренного при нормальных условиях. Вычислить эквивалентную массу металла.
137. Одной из операций при получении стали бессемеровским методом является соединение основных оксидов металлов с оксидом кремния (IV) по уравнению: MnО + SiO2 → MnSiO3. При использовании 100 г шлака, содержащего 25 % оксида кремния (IV), эквивалентная масса которого 15 г/моль, образовалось 109,2 г силиката марганца. Рассчитать эквивалентную массу силиката марганца.
138. Для восстановления 15,9 г хлорида железа было израсходовано 2,8 л водорода (н.у.). Рассчитать эквивалентную массу хлорида железа.
139. При сгорании 5,0 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла.
140. 1,0 г некоторого металла соединяется с 8,89 г брома или с 1,78 г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/экв.
141. Из 0,493 г хлорида металла после обработки нитратом серебра образовалось 0,861 г хлорида серебра. Вычислить эквивалентную массу металла.
142. Металл образует два хлорида с содержанием хлора 37,45 и 54,51 %. Вычислить эквиваленты металла в каждом соединении, приняв эквивалентную массу хлора равной 35,5 г/экв.
143. При взаимодействии 0,8 г гидразина и 2,45 г серной кислоты образовалось 3,25 г соли. Вычислить эквивалентные массы гидразина и образовавшейся соли.
144. На нейтрализацию 2,45 г кислоты идет 2,0 г гидроксида натрия. Определить эквивалентную массу кислоты.
145. Металл образует два хлорида, содержащие соответственно 73,86 % и 84,96 % металла. Вычислить эквивалентные массы металла в каждом соединении.
146. Эквивалентная масса металла 8,99 г/экв. Какой объем водорода при Т=3°С и давлении 106,6 кПа выделится при взаимодействии 0,449 г металла с соляной кислотой?
147. На нейтрализацию 1 г кислоты пошло 1,247 г КОН. Найти эквивалентную массу кислоты.
148. Из 2,5 г некоторого металла получили фосфат этого металла. Какова масса фосфата металла, если эквивалентная масса металла равна 4,5 г/моль?
149. Из 1,35 г оксида некоторого металла получили 3,15 г нитрата этого металла. Найти эквивалентную массу этого металла.
150. При взаимодействии 6 г некоторого вещества с 2,768 г хлороводородной кислоты получили 4,43 г соли. Вычислить эквивалентные массы вещества и соли.
151. При 700°С восстанавливают хлорид железа (степень окисления железа неизвестна) до металлического железа. Какова эквивалентная масса хлорида железа и какова его формула, если на восстановление 15,9 г этого хлорида израсходовали 2,8 л водорода (н.у.)?
152. Металл образует два хлорида с содержанием хлора 37,45 и 54,51 %. Вычислить эквиваленты металла в каждом соединении, приняв эквивалентную массу хлора равной 35,5.
153. На восстановление 8 г оксида металла до метала потребовалось 2,24 л водорода (н.у.). Найти эквивалентную массу металла.
154. Некоторое количество металла соединяется с 0,0312 г кислорода или с 0,3125 г одного из галогенов. Вычислить эквивалентную массу галогена и определить, что это за галоген.
155. Сколько металла вступило в реакцию с кислотой, если при этом выделилось 250 мл водорода (н.у.)? Эквивалентная масса металла равна 9 г/экв.
156. Зная, что 0,18 г металла соединяется с 84 мл кислорода (н.у.), вычислить эквивалентные массы металла и его оксида.
157. На нейтрализацию 2 г щелочи потребовалось 0,25 г кислоты, эквивалентная масса которой 100,5 г/моль. Определить эквивалентную массу щелочи.
158. 0,075 г металла вытесняют из раствора никелевой соли 0,1835 г никеля, а из раствора кислоты 70 мл водорода (н.у.). Определить эквивалентные массы металла и никеля.
159. Кусок металла, эквивалентная масса которого 29,335 г/моль, вытесняет из кислоты 105 мл водорода (н.у.). Определить эквивалентную массу металла.
160. Определить эквивалентную массу щелочи, зная, что 0,2 г ее взаимодействуют с 0,271 г хлорного железа, эквивалентная масса которого 54,08 г/экв.
161. При восстановлении 1,252 г оксида металла получен 1 г металла. Определить эквивалентные массы металла и его оксида.
162. При синтезе аммиака израсходовано 22,4 мл азота (н. у.). Сколько аммиака может быть при этом теоретически получено?
163. При сжигании 3 кг каменного угля получили 5,3 м3 CO2 (н. у.). Какова массовая доля углерода в данном образце каменного угля?
164. Какой объем воздуха (н. у.) потребуется для обжига пирита по реакции 4 FeS2 + 11 O2 ® 2 Fe2O3 + 8 SO2, чтобы получить 1000 м3 оксида серы (IV). Объемное содержание кислорода в воздухе – 21 %.
165. Вычислить, какой объем воздуха (н. у.) потребуется для обжига 2 т пирита, содержащего 92 % FeS2. Объемное содержание кислорода в воздухе – 21 %.
166. Какая масса раствора серной кислоты концентрацией 70 % потребуется для получения ортофосфорной кислоты из 200 кг по реакции Ca3(PO4)2+3H2SO4®2H3PO4+3CaSO4, фосфорита содержащего 70 % Ca3(PO4)2?
167. Для получения оксида магния из металлического магния потребовалось 5 л воздуха, измеренных при температуре 27°С и давлении 1,3 атм. В воздухе содержится 21 % кислорода. Сколько оксида магния можно при этом получить?
168. Основной минерал, содержащий олово – касситерит (SnO2). Металлическое олово из него получают восстановлением коксом. При этом выделяется оксид углерода (IV). Какой объем оксида углерода выделится при восстановлении 3,02 кг касситерита, если процесс вести при температуре 127°С и давлении 1,5 атм?






