Другим известным примером Х-сцепленного рецессивного заболевания является прогрессирующая псевдогипертрофическая мышечная дистрофия Дюшенна/Беккера. Первый вариант заболевания, подробно описанный Г. Дюшенном в 1868 году, представляет собой одну из наиболее частых и злокачественных форм нервно-мышечной патологии детского возраста. Частота заболевания составляет 1 на 3-5 тысяч новорожденных мальчиков. В 1955 году П. Беккер описал более мягкий вариант Х-сцепленной прогрессирующей мышечной дистрофии, встречающийся с частотой 1 на 20- 25 тысяч лиц мужского пола. В течение долгого времени шли дискуссии о том, являются эти заболевания одной или разными нозологическими формами. В настоящее время убедительно доказано, что это одно заболевание, обусловленное разными мутациями в одном и том же гене миодистрофии Дюшенна - DMD.
Первые признаки миодистрофии Дюшенна появляются в возрасте 2-7 лет. Для большинства больных характерна задержка раннего моторного развития. При начале ходьбы (в возрасте 14 месяцев и старше) отмечаются частые падения, неловкость в движениях, быстрая утомляемость. Постепенно походка становится переваливающейся, затем появляются затруднения при подъеме по лестнице, вставании из положения на корточках, ходьбе. Развивается псевдогипертрофия преимущественно икроножных и дельтовидных мышц, создающая ложное впечатление атлетического телосложения - рис.71. Затем псевдогипертрофия трансформируется в гипотрофию. Патологический процесс носит восходящий характер. Первыми поражаются мышцы тазового пояса и проксимальных отделов нижних конечностей, затем мышцы плечевого пояса, спины и проксимальных отделов верхних конечностей. По мере развития заболевания возникают вторичные деформации позвоночника (поясничный гиперлордоз, кифоз, сколиоз), грудной клетки, которая становится седловидной или килевидной, стоп. Формируются «осиная талия», крыловидные лопатки, симптом «свободных надплечий». Постепенно развиваются обездвиженность, рестракции сухожилий, контрактуры суставов. Вместе с уменьшением массы мышц угнетаются рефлексы. Сопутствующим признаком заболевания является кардиомиопатия, которая проявляется в виде гипертрофии левого желудочка и аритмии. Примерно у четверти больных диагностируется олигофрения в степени дебильно-сти. Больные сохраняют способность к ходьбе до 10-12-летнего возраста, после чего передвигаются только с помощью инвалидной коляски. Основной причиной летального исхода в возрасте до 20-25 лет являются интеркуррентные инфекции, которые больной не в силах перенести из-за включения в патологический процесс дыхательной мускулатуры.
Прогрессирующая мышечная дистрофия Беккера дебютирует обычно во второй декаде жизни с появления слабости и утомляемости мышц тазового пояса и ног. Одним из ранних симптомов, проявляющихся у значительного числа больных, являются болезненные мышечные спазмы. Симптомы мышечной дистрофии при двух формах заболевания носят сходный характер, но при форме Беккера выражены значительно слабее. Гипертрофическая или дилатационная кардиомиопатия диагностируется у 50-60% больных. Болезнь носит медленно прогрессирующий характер, инвалидизация наступает чаще всего после 40 лет. При этом интеллект, как правило, сохранен. Больные вступают в брак, имеют здоровых детей, работоспособны.
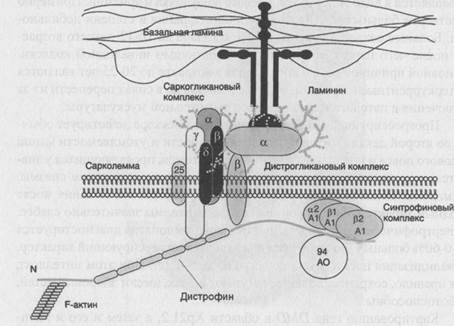
Картированию гена DMD в области Хр21.2, а затем и его и идентификации способствовало описание единичных случаев миодистрофии Дюшенна у девочек. Эти девочки оказались носителями редких транслокаций между Х-хромосомой и одной из аутосом, причем таких, которые разрушали ген миодистрофии Дюшенна. Основным продуктом гена DMD в мышцах является структурный стержневидный белок дистрофии, принадлежащий к спектрин/а-актининовому суперсемейству белков цитоскелета. Это полифункциональный белок, обеспечивающий поддержание целостности мембраны мышечного волокна при раундах сокращения-расслабления, а также участвующий в формировании ней-ромышечного синапса. Дистрофии состоит из четырех доменов и располагается на цитоплазматической поверхности мышечной сарколеммы -рис.72. N-концевой домен дистрофина связан с цитоскелетом мышечного волокна. Затем идет самый крупный домен, обеспечивающий гибкость молекулы.
Он имеет структуру трехгранного стержня и образован 24 слегка повторяющимися мотивами. За стержневым доменом следуют два очень важные в функциональном отношении домена - цистеин-богатый и С-концевой. В области цистеин-богатого домена формируются кальциевые каналы и осуществляется связь дистрофина, а значит и цитоскелета мышечного волокна с внеклеточным матриксом через трансмембранный комплекс дистрофин-ассоциированных белков, которые, в свою очередь, разделяют на два субкомплекса - саркогликановый и дистрогликановый. В области С-концевого домена располагается синтрофиновый комплекс дистрофин-ассоциированных белков, функции которого особенно важны для формирования нейромышечного синапса. В 65-70% случаев у больных миодистрофией Дюшенна/Беккера диагностируются протяженные внутригенные делеции, затрагивающие несколько соседних экзонов, причем эти делеции характерны для обеих форм заболевания. Различия в их характере заключаются в том, что при миодистрофии Дюшенна делеции сопровождаются сдвигом рамки считывания. В этих случаях дистрофии у больных вообще не образуется. При форме Беккера делеции не нарушают рамку считывания, и дистрофин у больных синтезируется, хотя конечно, он имеет аномалии. Клинические проявления подобных делеции зависят от их протяженности и локализации. Так, например, описан больной с очень мягкой формой миодистрофии Беккера, диагностированной в среднем возрасте (после 40 лет), у которого при молекулярном анализе была выявлена протяженная делеция, затрагивающая более 40% гена. Однако эта делеция была так удачно расположена, что в мутантном дистрофине отсутствовал внутренний участок стержневого домена, в то время как функционально значимые домены 1, 3 и 4 оказались совершенно сохранными. Это и обеспечило такое мягкое течение заболевания.. С другой стороны гораздо меньшие по размеру
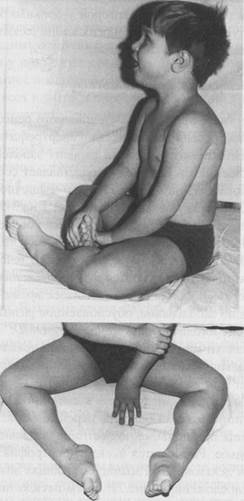
Рисунок 71. Гипертрофия икроножных мышц при миодистрофии Дюшенна.
делеции и даже точковые мутации, затрагивающие цисеин-богатый и С-концевые домены дистрофина, могут быть ассоциированы с тяжелой клиникой миодистрофии Дюшенна. В гене DMD идентифицированы также другие внутригенные перестройки (дупликации, микроделеции), а также много нонсенс-мутаций, сопровождающихся преждевременным прекращением синтеза белка.
Миссенс-мутации в гене DMD встречаются редко. Все идентифицированные у больных мутации приводят к разрушению дистрофин-ассоциированного комплекса белков, что и служит патогенетической основой для развития мышечной дистрофии при этом заболевании.
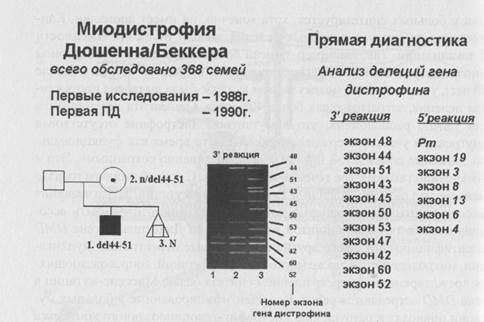
Молекулярная диагностика делеции в гене DMD проводится с использованием мультиплексной (множественной) ПЦР, что позволяет во многих семьях высокого риска проводить профилактику заболевания на базе пренатальной диагностики. На рис.73 представлен пример пре-натальной диагностики делеции в гене DMD методом мультиплексной ПЦР и указано количество семей больных, обследованных в лаборатории пренатальной диагностики наследственных и врожденных заболеваний ИАГ им. Д. О. Отта РАМН (зав. лаб. чл-корр. РАМН проф. В. С. Баранов).
В 30% семей мать больного миодистрофией мальчика не является носителем мутации, а болезнь у сына развивается в результате спонтанного возникновения мутации de novo в её яйцеклетках. Такую ситуацию очень важно диагностировать, так как в этом случае риск повторного рождения больного ребенка может быть значительно меньше и в некоторых случаях не превышает общепопуляционного. Разработаны специальные методы для выявления гетерозиготного носительства мутаций в гене DMD, в частности, иммуногистохимический анализ дистрофина в биоптате мышц
|
Рисунок 72. Структура дистрофина и дистрофин-ассоциированного комплекса белков.
.
|
Рисунок 73. Диагностика делеций в гене DMD у больных миоди-строфией Дюшенна (данные 2002 г.).
Возможна иммунологическая диагностика заболевания с использованием специфических антител на дистрофии. Материалом для исследования в этом случае является образец мышцы, полученной методом биопсии.
Серьезную проблему для медико-генетического консультирования представляют случаи гонадного мозаицизма, обусловленного возникновением мутации в первичных половых клетках, то есть на ранних стадиях внутриутробного развития будущей матери. Считается, что 6-7% всех спорадических случаев являются следствием гонадного мозаицизма у матери. При этом оценить величину аномального клона ооцитов не представляется возможным. Эмпирический риск повторного рождения больного ребенка в спорадических случаях миодистрофии Дюшенна и при отсутствии доказательств гетерозиготного носительства мутации у матери достигает 14%, и это делает обоснованным пренатальную диагностику заболевания не только в семейных, но и в спопалических cnv чаях.
Болезни экспансии
К болезням экспансии относятся наследственные заболевания, обусловленные динамическими мутациями. В основе динамических мутаций лежит нестабильность микро- и минисателлитных повторов ДНК, локализованных в значимых областях генов. При болезнях экспансии наблюдается превышение (экспансия) определенного порогового уровня числа повторяющихся элементов в месте локализации динамической мутации. Подобные экспансии сопровождаются нарушениями работы гена, причем конкретные механизмы этих нарушении различны для разных типов динамических мутаций. Различия определяются, главным образом, двумя факторами: функциональной значимостью того участка гена, где расположен нестабильный повтор, а также характером и функциями самого повтора.
В настоящее время насчитывается более 20 болезней экспансии, подавляющее большинство из них связаны с экспансией тринуклеотидных повторов. Это синдром Мартина-Белл (синдром фрагильной или ломкой Х-хромосомы), миотоническая дистрофия, атаксия Фридрейха, целая серия спиноцеребеллярных атаксий, хорея Гентингтона и ряд других. Болезни экспансии могут быть аутосомными или Х-сцепленными в зависимости от локализации мутантного гена. Механизмы патогенетического действия динамических мутаций зависят от расположения и специфики экспансированного повтора, а тяжесть течения заболевания определяется длиной экспансии (числом повторов). При тяжелых формах заболевания идентифицируются более длинные повторы.
Практически для всех заболеваний, обусловленных динамическими мутациями, характерно поражение головного мозга и особенно подкорковых структур. Поэтому болезни экспансии представляют особую значимость для неврологии. Однако клиническая картина при различных болезнях экспансии достаточно разнообразна. Болезни экспансии имеют много общих особенностей, касающихся не только клинической картины поражения, но механизмов возникновения динамических мутаций, а также молекулярных и биохимических основ патогенеза этих заболеваний.
Для многих болезней экспансии характерны следующие особенности наследования (1) доминантный или полудоминантный характер, (2) антиципация - нарастание тяжести течения заболевания в ряду поколений и (3) геномный импринтинг. Дифференциальный характер поражения при разных болезнях экспансии, в первую очередь, определяется функциями белков, являющихся первичными биохимическими дефектами, а также различиями в тканеспецифической экспрессии соответствующих генов. Остановимся более подробно на некоторых из этих заболеваний.
Синдром Мартина-Белл
Впервые динамические мутации были идентифицированы в гене FRAXA, мутантном при синдроме Мартина-Белл или синдроме ломкой (фрагильной) Х-хромосомы.
В клинической картине этого сцепленного с полом заболевания ведущим симптомом является интеллектуальный дефект различной степени выраженности (IQ 13-75) в сочетании с поведенческими, лицевыми и соматическими аномалиями. У большинства больных встречаются психопатические и речевые нарушения в виде двигательной расторможенности, признаков аутизма, персевераций, эхола-лии. В 10-15% случаев наблюдается судорожный синдром. В соматическом статусе пациентов с синдромом Мартина-Белл нередко отмечаются долихоцефалия, макроцефалия, выступающий лоб, удлиненное лицо, крупные, выступающие («оттопыренные») ушные раковины, эпикант, светлые радужки, нос с клювовидным кончиком, массивный подбородок, крупные кисти и стопы, гипермобильность суставов, макроорхизм. Последний признак, особенно четко выявляемый в постпубертатном периоде, является высокоинформативным симптомом и наряду с умственной отсталостью входит в «фенотипическое ядро» синдрома.
Синдром описан в 1943 году J. Martin и J. Bell. Наиболее существенным в изучении этиологии этого заболевания явилось цитогенетическое исследование. При культивировании лимфоцитов больных мужчин в среде, лишенной фолата, в них обнаруживаются цитогенетические изменения в виде перетяжек района 27-28 длинного плеча Х-хромосомы. Данный цитогенетический феномен получил название фрагильности (ломкости) Х-хромосомы, и он служит цитогенетическим маркером заболевания - marXq28. Распространенность синдрома Мартина-Белл в общей популяции составляет 1:2000 среди лиц мужского пола, то есть это вторая по встречаемости форма умственной отсталости после синдрома Дауна. Для синдрома Мартина-Белл характерны варьирующая экспрессивность, неполная пенетрантность и полудоминантный характер наследования. В ряде семей прослежена передача мутантного аллеля через мужчин, так называемых нормальных трансмиттеров, не имеющих выраженных клинических признаков болезни или имеющих очень стертые формы неспецифической умственной отсталости. Они составляют 20% среди мужчин, несущих мутантный аллель в гене FRAXA (иногда его обозначают как FMR1).
Рисунок 5. Больной синдромом Мартина-Белл.
У 85% матерей больных детей IQ не превышает 85, причем уровень снижения интеллекта коррелирует с экспрессией цитогенетического маркера заболевания (marXq28). У 40% облигатных гетерозигот наблюдаются типичные лицевые особенности, более выраженные у взрослых, чем у детей, а также неровные зубы и гипермобильность суставов пальцев. При этом гетерозиготные женщины, получившие мутантный аллель от фенотипически нормального отца-трансмиттера, всегда интеллектуально сохранны. В первичных культурах лимфоцитов таких женщин отсутствуют клетки с фрагильными сайтами или имеется очень небольшой их процент. В отличие от этого, у больных мальчиков следующего поколения интеллект значительно снижен, и количество лимфоцитов с перетяжками в области Xq27-28, в среднем, составляет 29%. Третья особенность наследования синдрома Мартина-Белл заключается в геномном импринтинге, следствием которого является антиципация заболевания при прохождении мутантного аллеля через женский гаметогенез. Эти особенности наследования заболевания получили название парадокса Шермана.
Открытие в начале 90-х годов гена, ответственного за синдром Мартина-Белл (FRAX), и расшифровка молекулярной природы идентифицированных у больных мутаций позволили полностью объяснить парадокс Шермана. Оказалось, что в промоторной области гена FRAX расположен нестабильный тринуклеотидный повтор CGG. В норме количество CGG-триплетов не превышает 40. У больных это число может увеличиваться до 1000, причем, как правило, увеличение происходит в два этапа. Сначала появляется аллель с числом повторов в диапазоне от 40 до 50 - премутация, который чаще всего и присутствует у нормальных трансмиттеров. При прохождении этого нестабильного повтора через оогенез может происходить дальнейшее достаточно резкое нарастание числа CGG-копий с образованием мутации.
При экспансии CGG-повтора наблюдается различная степень метилирования промотора гена FRAX, что и приводит к снижению уровня его транскрипции. У пациентов с мягкими формами заболевания наблюдается мозаицизм по метилированию промоторной области гена. Мутантный аллель, по-видимому, неметилирован у нормальных мужчин-трансмиттеров, метилирован только в неактивной Х-хромосоме у их дочерей и полностью метилирован у большинства больных сыновей этих дочерей. У некоторых из них наблюдается мозаичная картина по характеру метилирования.
Миотоническая дистрофия
Вскоре вслед за тем, как была расшифрована природа молекулярного дефекта при синдроме Мартина-Белл, было показано, что в основе развития миотонической дистрофии лежит другая динамическая мутация - экспансия CTG-повтора, локализованного в З'-нетранслируемой области гена DM.
Клиническая картина миотонической дистрофии представляет собой сочетание миотонии, миопатии, сердечно-сосудистых нарушений и эндокринно-вегетативных расстройств. Болезнь дебютирует иногда в детском возрасте, но чаще во втором-третьем десятилетии жизни признаками миотонического спазма и затруднений в разгибании пальцев рук при резких движениях. Течение болезни неуклонно прогрессирующее. На фоне усиливающегося миотонического синдрома развивается мышечная слабость и атрофические проявления, сходные с миопатиями. Первыми слабеют мышцы лица, особенно круговая мышца глаз, века, жевательные мышцы. А также сгибатели шеи и некоторые мышцы конечностей. Слабость и атрофии мышц возникают одновременно. Глубокие рефлексы постепенно снижаются и в дальнейшем угасают. Типичны катаракты и различная степень интеллектуальной недостаточности. В разных популяциях заболевание встречается с частотой 1 на 8-40 тысяч, наследуется по аутосомно-доминантному типу. Во многих семьях наблюдается антиципация как по дебюту, так и по тяжести течения. Мужчины болеют в 3 раза чаще, чем женщины.
Ген DM расположен в области 19ql3.2-3. CTG-повтор в 3?-нетранслируемой области гена DM отличается крайней нестабильностью. В норме число триплетов варьирует в пределах от 5 до 30-37. У больных миотонической дистрофией количество CTG-триплетов значительно больше и составляет не менее 50 при наиболее мягких формах болезни, от 100 до 1000 у пациентов с классическим течением и дебютом во взрослом возрасте, в то время как при врожденных формах заболевания оно может достигать 3000. Начальным шагом, предрасполагающим к мутационному событию, является увеличение числа CTG-повторов от 5 до 19-30. Частота этого гетерогенного класса повторов в популяции достигает 10%, и, по-видимому, эти аллели составляют резерв для повторного мутирования. Аллели, связанные с относительно небольшими экспансиями обладают высокой мейотической нестабильностью, что и объясняет наблюдаемую антиципацию. Наиболее вероятным патогенетическим механизмом миотонической дистрофии является локальное нарушение структуры хроматина в области локализации удлиненного CTG-повтора, которое может приводить к инактивации не только гена DM, но и, возможно нескольких других соседних генов. Не исключено, что именно с этим связан высокий плейотропизм заболевания - одновременное вовлечение в патологический процесс нескольких систем.






