32.1. При взаимодействии бутанола-1 с избытком металлического натрия выделился водород, занимающий при нормальных условиях объем2,8 л. Определить количество вещества бутанола-1, которое вступило в реакцию.
(Ответ: 0,25 моль).
32.2. Назвать вещества Х и Y и написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) пропанол-1 → Х → пропанол-2; б) этанол → Y → 1,2-дихлорэтан.
Указать условия протекания реакций.
32.3. Для получения метанола использовали 2 м3 оксида углерода (II) и 5 м3 водорода при нормальных условиях. Получено 2,04 кг спирта. Определить выход спирта. (Ответ: 71,4 %).
32.4. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
С → СН4 → С2Н6 → С2Н4 → С2Н5ОН → С2Н5ОNa.
32.5. Определить массу фенолята натрия, который может быть получен при взаимодействии 4,7 г фенола с 4,97 мл 35 %-го раствора NaОН (ρ = 1,38 г/мл). (Ответ: 5,8 г).
32.6. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
хлорэтан → этанол → этилен → пропаналь.
32.7. При окислении 13,8 г этанола избытком оксида меди (II) получен альдегид, масса которого составила 9,24 г. Определить выход продукта реакции. (Ответ: 70 %).
32.8. Определить массу серебра, которая будет получена, если к избытку аммиачного раствора оксида серебра прибавить 50 г 11,6 %-го водного раствора пропаналя. (Ответ: 21,6 г).
32.9. Какое количество вещества НСНО содержится в его 30 %-м водном растворе объемом 3 л и плотностью 1,06 г/мл? (Ответ: 31,8 моль).
32.10. 280 мл ацетилена было использовано для получения ацетальдегида, выход которого составил 80 %. Какая масса серебра может образоваться при добавлении всего полученного альдегида к избытку аммиачного раствора оксида серебра? (Ответ: 1,08 г).
32.11. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С → СаС2 → С2Н2 → С2Н4 → С2Н6 → С2Н5Cl → С2Н5ОН.
32.12. При окислении 6 г технического препарата этаналя аммиачным раствором оксида серебра образовалось 20 г металла. Определить массовую долю (%) этаналя в техническом препарате. (Ответ: 67,9 %).
32.13. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → ацетилен → уксусный альдегид → этиловый спирт → уксусный альдегид.
32.14. Составить уравнения реакций, при помощи каких реакций можно осуществить следующие превращения:
С → СН4 → С2Н2 → С6Н6 → С6Н5Cl → С6Н5ОН.
32.15. Рассчитать массу фенолята калия, которая может быть получена из 3,29 г фенола. (Ответ: 4,62 г).
32.16. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
уксусный альдегид → этанол → этилен → ацетилен → уксусный альдегид.
32.17. Написать уравнения реакций, которые надо провести для осуществления следующих превращений:
а) СН4 → Х → СН3ОН → СН3−О−СН3; б) этанол → этилен → Y → этанол.
Назвать вещества Х и Y.
32.18. При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2 %. Определить массу пропанола-2, взятого для реакции. (Ответ: 2,4 г).
32.19. Рассчитать массу фенола, который можно получить гидролизом бромбензола массой 47,1 г, если массовая доля выхода продукта равна 40 %.
(Ответ: 11,28 г).
32.20. Составить уравнения реакций, которые необходимо провести для осуществления следующих превращений: пропин → Х → ацетон.
Назвать вещество Х, указать условия протекания реакций.
Органические кислоты
Теоретическое введение
Карбоновые кислоты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на карбоксильную группу
Особенности химических свойств карбоновых кислот обусловлены сильным взаимным влиянием карбонильной
и гидроксильной О−Н групп.
Поэтому все химические реакции карбоновых кислот будут идти по следующим направлениям:
Замещение водорода в гидроксильной группе. Карбоновые кислоты – слабые электролиты и взаимодействуют с активными металлами, оксидами и гидроксидами металлов с образованием солей:
2CH3COOH + Mg → Mg(CH3COO)2 + H2;
уксусная кислота ацетат магния
C2H5COOH + NaOH → C2H5COONa + H2O.
пропионовая кислота пропионат натрия
Замещение всей гидроксильной группы. Карбоновые кислоты реагируют со спиртами в присутствии сильных неорганических кислот, в результате образуется сложный эфир:
пропионовая метиловый метиловый эфир пропионовой кислоты
кислота спирт (метилпропионат)
Примеры решения задач
Пример 33.1. Составить уравнения реакций, которые надо провести для осуществления следующих превращений: Метан → X → Y → уксусная кислота.
Назвать вещества X и Y.
Решение. При нагревании метана получают ацетилен – вещество Х:
2СН4 → С2Н2 + 3Н2.
Гидратацией ацетилена в присутствии солей ртути (II) синтезируют уксусный альдегид – вещество Y:
C2H2 + H2O → CH3COH.
Окислив уксусный альдегид кислородом воздуха в присутствии катализатора, получают уксусную кислоту:
2СН3СОН + О2 → 2СН3СООН.
Пример 33.2. В трех пробирках без надписей находятся следующие вещества: этанол, муравьиная кислота, уксусная кислота. Какие химические реакции следует провести, чтобы различить эти вещества?
Решение. Спирт (этанол) можно отличить по действию веществ на индикаторы. Например, кислоты окрашивают синий лакмус в красный цвет, спирт – нет.
Различить муравьиную и уксусную кислоту легко, так как муравьиная кислота проявляет некоторые свойства альдегидов. Например, она вступает в реакцию «серебряного зеркала» (уксусная – нет):
НСООН + Ag2O → CO2↑ + 2Ag + H2O.
Пример 33.3. Какой объем уксусной эссенции плотностью 1,07 г/мл надо взять для приготовления столового уксуса объмом 200 мл и плотностью 1,007 г/мл? Массовая доля уксусной кислоты в уксусной эссенции равна 80 %, в столовом уксусе – 6 %.
Решение. Определяем массу раствора уксуса, который надо приготовить:
m = V ∙ ρ; m = 200 ∙ 1,007 = 201,4 г.
Рассчитаем массу уксусной кислоты, которая содержится в уксусе:
m (CH3COOH) = m ∙ ω (CH3COOH) = 201,4 ∙ 0,06 = 12,1 г.
Вычисляем массу уксусной эссенции m ′, которая содержит уксусную кислоту массой 12,1 г:

 г.
г.
Находим объем уксусной эссенции:

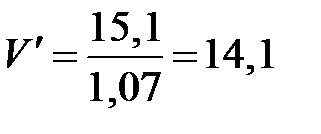 мл.
мл.






