Широкое применение в технике получения нанопорошков получили импульсные лазерные методы. Для получения, например, наночастиц серебра используется следующая установка:

Рис. 12.20. Схема установки для лазерного метода получения наночастиц
Раствор нитрата серебра и восстановителя протекает через смеситель, представляющий собой диск, вращающийся в растворе. Нитрат серебра реагирует с восстановителем в горячих областях с образованием наночастиц серебра, выделяемых впоследствии из раствора в центрифуге. На размер частицы можно влиять энергией лазерного луча и скоростью вращения диска. Описанный метод обладает выходом продукта ~2-3 г/мин.
В данной главе было приведено множество примеров, демонстрирующих зависимость физических, химических и электронных свойств наночастиц от количества, размеров и типов атомов, составляющих нанокластеры. В некоторых случаях наночастицы демонстрируют новые свойства, отсутствующие у того же материала в массивном состоянии, например магнетизм кластеров, состоящий из немагнитных атомов. Помимо постановки задач перед учеными, связанных с объяснениями причин такого поведения наночастиц, эти особенности имеют огромный потенциал для использования на практике, позволяя создавать материалы нового класса – а именно, материалы, конструируемые на атомарном уровне.
Глава 13. УГЛЕРОДНЫЕ НАНОСТРУКТУРЫ
13. 1. Природа углеродной связи
Рассмотрим особенности углеродной связи и электронную структуру атома углерода. В нем имеется шесть электронов, которые в невозбужденном состоянии находятся на низших энергетических уровнях. Когда атом углерода связан в молекуле с другими атомами, его электронная структура выглядит так: (1 s)2(2 s)(2 px)(2 py)(2 pz).
На нижнем уровне – 1 s – находятся два электрона с противоположно направленными спинами. Распределение заряда электрона в s -состоянии сферически симметрично, и 1 s -электроны не принимают участие в образовании химических связей. Остальные четыре электрона находятся на уровне с n = 2: один на сферически симметричной s- орбитали, а остальные три на рx-, рy-, рz -орбиталях. Распределение заряда на р -орбиталях имеют сильно удлиненную в одном направлении форму:

Рис. 13.1. Распределение заряда на р -орбиталях атома углерода
Внешняя s -орбиталь и 3 р -орбитали формируют химические связи атома углерода с другими атомами. Распределение зарядов, связанных с этими орбиталями, смешивается (перекрывается) с распределением заряда каждого связанного с углеродом атома. Однако, если бы все было так просто, то, например, молекула метана CH4 имела бы связи Н-С, располагающиеся под углом 90о. В действительности же структура молекулы метана обладает тетраэдрической структурой. Этот факт объясняется в рамках концепции гибридизации связей.
В атоме углерода разность энергий между 2 s - и 2 р -уровнями мала, что позволяет волновым функциям 2 s -состояний смешиваться с одной или несколькими волновыми функциями 2 р -состояния. Ненормированная волновая функция ψ валентного состояния может быть записана в виде: 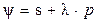 , где р – смесь р i числа орбиталей,
, где р – смесь р i числа орбиталей,  – коэффициент смешивания.
– коэффициент смешивания.
При такой гибридизации направление лепестков р -орбиталей и углы между ними меняются. Углы зависят от относительного коэффициента смешивания λ числа р -состояний с s -состояниями. Большинство углов между связями углерода в органических молекулах имеют значение 180о, 120о, 109о28’.
Твердый углерод имеет две основные формы, называемые аллотропными модификациями, – алмаз и графит. Эти модификации стабильны при комнатной температуре. Алмаз состоит из атомов углерода, тетраэдрически связанных друг с другом посредством sр 3-гибридизованных связей, образующих трехмерную сетку. Графит имеет слоистую структуру, где каждый слой образован шестиугольниками из атомов углерода, связанных посредством sр 2-гибридизации.
13.2. Малые углеродные кластеры – С60.
Для получения кластеров углерода может быть использовано лазерное испарение подложки в потоке гелия с помощью установки, изображенной на рис. 12.1. В этом случае пучок электронейтральных кластеров фотоионизируется ультрафиолетовым лазером и анализируется масс-спектрометром. В результате получается спектр, подобный тому, что изображен на рис. 13.2.
Видно, что в спектре выделяются пики атомов для фуллеренов С60 и С70. Используя метод молекулярных орбиталей, устананавливают, что линейная структура кластеров с sр -гибридизацией наблюдается при нечетных значениях N, а циклическая – при четных. Другие пики, которые заметны на масс-спектре, видимо, имеют большую стабильность структуры. Открытие молекулы, похожей на футбольный мяч, явилось в некотором смысле случайным результатом исследования природы материи в межзвездном пространстве. Несмотря на то, что молекулу С60, похожую на футбольный мяч, химики-теоретики предсказывали много лет назад, никаких доказательств ее существования обнаружено не было. И только благодаря исследованиям Хоффмана и Кратчмера четыре полосы поглощения осажденного ״графитного״ вещества из ״межзвездной пыли״ достаточно точно соответствовали предсказаниям для молекулы С60. Собственно фуллереном молекула С60 была названа по имени архитектора и изобретателя Р.Бакминстера Фуллера, построившего сооружение, напоминающее структуру С60.
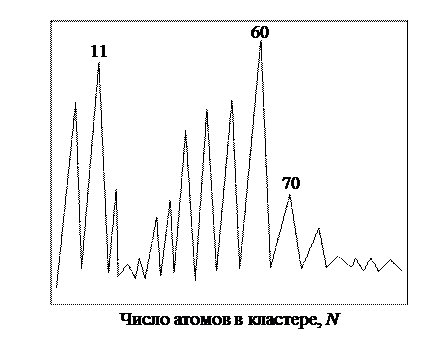
Рис. 13.2. Масс-спектр углерода
Первоначально молекулу назвали бакминстерфуллереном, но название было настолько неудобно, что его сократили просто до фуллерена. Геометрия молекулы фуллерена ближе к форме футбольного мяча, состоящего из 5- и 6-гранных фасеток. Эти шарообразные молекулы могут соединяться друг с другом в твердом теле с образованием ГЦК кристаллической решетки.

Рис. 13.3. Элементарная ячейка кристаллической решетки
фуллерена С60, легированного щелочными металлами
На рис. 13.3 изображена элементарная ячейка кристаллической решетки фуллерена С60 (большие шары), легированного щелочными атомами (темные шары). Расстояние между центрами ближайших молекул С60 в такой решетке составляет по теоретическим оценкам порядка 1 нм. Кстати тот факт, что в структуре фуллерена 26% объема элементарной ячейки пустует, позволяет легко легировать фуллерен атомами щелочных металлов: Li, Na, K, Rb, Cs.






