Цель работы: изучение способов получения и химических свойств основных классов неорганических соединений и взаимосвязи между ними.
Неорганические соединения по составу делятся на гомо- и гетеросоединения. Гомосоединения – это вещества, состоящие из атомов одного элемента. Они условно подразделяются на металлы и неметаллы. Гетеросоединения, или сложные вещества, состоят из атомов двух или более элементов. Они делятся на классы: оксиды, основания, кислоты, соли. Основания и кислородсодержащие кислоты рассматриваются как единый класс – гидроксиды.
Оксиды, их получение и свойства
Оксидами называются бинарные соединения, в которых один из элементов – кислород. Например: K2O, SO2.
Оксиды делятся:
– на несолеобразующие или безразличные (N2O, NO, CO, SiO);
– солеобразующие: а) основные; б) амфотерные; в) кислотные.
Основные оксиды – это оксидыметаллов со степенью окисления металла +1, +2. Исключение составляют оксиды BeO, ZnO, SnO, PbO, являющиеся амфотерными.
Основными называются оксиды, которые взаимодействуют с кислотами, образуя соли. Основным оксидам отвечают гидроксиды – основания. Например:
Основной оксид
Na  O
Ca+2O O
Ca+2O
| Основание Na+1OH Ca+2(OH)2 |
Амфотерные оксиды – оксиды металлов со степенью окисления металла +3, +4 и BeO, ZnO, SnO, PbO со степенью окисления +2.
Амфотерными называются оксиды, которые взаимодействуют как с кислотами, так и с основаниями (щелочами, растворимыми в воде основаниями), образуя соли. Амфотерным оксидам отвечают гидроксиды, проявляющие как свойства кислот, так и свойства оснований. Например:
Амфотерный оксид
Be+2O
Cr  O3 O3
| Основание Be+2(OH)2 Cr+3(OH)3 | Кислота H2Be+2O2 HCr+3O2 |
Кислотные оксиды – оксиды неметаллов (кроме несолеобразующих оксидов) в любой степени окисления и оксиды металлов в высоких степенях окисления (+5 и выше).
Кислотными называют оксиды, которые взаимодействуют с основаниями, образуя соли. Кислотным оксидам отвечают гидроксиды – кислоты. Например:
Кислотный оксид
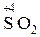

| Кислота
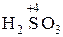

|
Выполнение работы
Опыт 1.1. Получение оксидов непосредственным взаимодействием простых веществ. В металлическую ложечку поместите небольшое количество серы и подожгите в пламени горелки. Внесите ложечку с горящей серой в колбу. После того как горение закончится, выньте ложечку, налейте в колбу немного дистиллированной воды и добавьте несколько капель лакмуса. Как изменилась окраска лакмуса? Определите реакцию среды. Напишите уравнения соответствующих реакций.
Опыт 1.2. Получение оксидов разложением солей. В сухую пробирку поместите небольшое количество (на кончике шпателя) карбоната гидроксомеди. Нагрейте пробирку с солью в пламени горелки до полного ее разложения. Отметьте цвет образовавшегося вещества и конденсацию капель воды на холодной части пробирки. Напишите уравнение реакции разложения соли.
Опыт 1.3. Получение оксидов разложением нерастворимых оснований. В пробирку налейте 1-2 мл раствора сульфата меди и добавьте 2 н. раствор гидроксида натрия. Отметьте цвет образовавшегося осадка. Нагрейте содержимое пробирки до изменения окраски осадка. Почему изменилась окраска? Составьте уравнения происходящих реакций.
Опыт 1.4. Отношение оксидов к воде. В одну пробирку поместите немного оксида кальция, в другую – оксида меди. Налейте в каждую пробирку 1-2 мл дистиллированной воды и добавьте несколько капель фенолфталеина. Объясните изменение окраски раствора в первой пробирке. В каком случае происходит реакция оксида с водой? Напишите уравнение реакции.
Опыт 1.5. Установление характера оксида. В одну пробирку поместите небольшое количество оксида меди, в другую – оксид цинка, добавьте 1-2 мл 2 н. раствора серной кислоты, осторожно нагрейте. Напишите уравнения реакций, отметьте окраску образовавшихся растворов.
Повторите опыт, добавив к небольшому количеству (несколько кристаллов) оксидов меди и цинка по 1-2 мл 30%-ного раствора гидроксида натрия. Пробирки нагрейте. Что наблюдаете? Напишите уравнения реакций. Сделайте вывод о химической природе исследуемых оксидов.






