Цель работы: определение молярной массы эквивалента металла методом вытеснения водорода из кислоты.
Эквивалент – это реальная или условная частица вещества, которая равноценна (эквивалентна) одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Используется также другое определение эквивалента: эквивалентом вещества называется реальная или условная частица этого вещества, которая взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
Для определения молярных масс эквивалентов 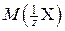 простых и сложных веществ удобно использовать понятие фактор эквивалентности (f экв). Фактором эквивалентности для вещества называется число, показывающее, какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода H+ в реакциях обмена или одному электрону в окислительно-восстановительной реакции.
простых и сложных веществ удобно использовать понятие фактор эквивалентности (f экв). Фактором эквивалентности для вещества называется число, показывающее, какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода H+ в реакциях обмена или одному электрону в окислительно-восстановительной реакции.
 , (1)
, (1)
где z – число эквивалентности.
Значение молярной массы эквивалента вещества можно рассчитать по формуле:
 , (2)
, (2)
Для газообразных веществ удобно пользоваться понятием молярный объем эквивалента  , который представляет собой объем одного моль эквивалентов газообразного вещества.
, который представляет собой объем одного моль эквивалентов газообразного вещества.
Так, 1 моль эквивалентов водорода (один моль атомов Н) имеет массу 1 г. Используя следствие из закона Авогадро, нетрудно рассчитать объем, занимаемый одним эквивалентом водорода.
1 моль Н2 имеет массу 2 г и занимает объем 22,4 л, а объем, занимаемый одним эквивалентом водорода, который имеет массу 1 г, найдем из пропорции:
2 г Н2 → 22,4 л
1 г → х л
x = 11,2 л, т. е.  л/моль.
л/моль.
Аналогично можно рассчитать молярный объем эквивалента для кислорода, который будет равен:
 л/моль.
л/моль.
Введение в химию понятия эквивалент позволило сформулировать закон, называемый законом эквивалентов: массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов. Закон эквивалентов можно записать в следующем виде:
 или
или  , (3)
, (3)
где, m (X) и m (Y) – массы взаимодействующих веществ, 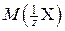 и
и  – молярные массы эквивалентов.
– молярные массы эквивалентов.
Если вещества находятся в газообразном состоянии, удобно пользоваться понятием молярный объем эквивалента и следующей формулировкой закона эквивалентов: объемы реагирующих друг с другом веществ пропорциональны молярным объемам их эквивалентов:
 , (4)
, (4)
где, V (X) и V (Y) – объемы реагирующих газообразных веществ,  и
и  – молярные объемы их эквивалентов.
– молярные объемы их эквивалентов.
Экспериментальное определение молярной массы эквивалента вещества выполняется прямым или косвенным способом. Прямое определение основано на точном измерении масс взаимодействующих веществ при известной молярной массе эквивалента одного из них.
Косвенное определение основано или на сравнении массовых долей элементов, входящих в полученное соединение, или на измерении массы или объема газообразных продуктов реакции. Например, молярную массу эквивалента активного металла определяют методом вытеснения водорода из кислоты, который основан на измерении объема водорода, выделившегося в условиях опыта. Взаимодействие металла с кислотой в общем виде можно представить уравнением:
Me + x HAn = MeAnx +  H2.
H2.
До проведения опыта должна быть известна масса металла, по окончании реакции измеряют объем выделившегося водорода и рассчитывают молярную массу эквивалента металла, используя закон эквивалентов.
Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из кислоты представлена на рис. 13. Он состоит из двух бюреток, закрепленных в штативе и соединенных между собой резиновой трубкой. К одной из бюреток присоединена стеклянная трубка с резиновой пробкой. К ней подбирается и присоединяется пробирка, в которой осуществляется реакция.

Рис. 13. Прибор для определения молярной массы эквивалента металла: 1 – бюретка 1; 2 – бюретка 2; 3 – пробирка.
Выполнение работы
1. Получите прибор и заполните бюретки наполовину дистиллированной водой с помощью воронки и стаканчика (бюретки со штатива не снимать и не двигать!).
2. Проверьте прибор на герметичность, поскольку результат работы зависит от точности измерения объема выделяющегося газа. Для этого подберите пробирку к резиновой пробке на стеклянной трубке и плотно присоедините ее к ней (круговыми движениями!). Чтобы создать давление в приборе, бюретку 2 поднимите на 10-15 см выше бюретки 1 (с помощью зажима на штативе, а не на бюретке!). Закрепите бюретку в этом положении, запомните показания уровней воды в бюретках (они должны быть разные) и, если в течение нескольких минут разность уровней не изменяется, то прибор герметичен. Если же происходит выравнивание уровней жидкости в бюретках, то следует проверить все места соединений, плотнее присоединить пробирку или поменять прибор и еще раз провести проверку на герметичность.
3. Отсоедините пробирку и верните бюретки в исходное положение (с помощью зажима на штативе, а не на бюретке!).
4. Получите у преподавателя пакетик с неизвестным металлом, масса точно взвешенного металла (до четвертого знака!) указана на пакетике, запишите ее в лабораторную тетрадь.
5. Разверните пакетик над листом бумаги (аккуратно, чтобы не рассыпать металл!) и перенесите содержимое на кусочек папиросной бумаги, в которую заверните навеску металла.
6. В пробирку, снятую с прибора, залейте 10%-ный раствор соляной кислоты на 1/3 часть объема.
7. Пакетик с металлом смочите дистиллированной водой и прикрепите его к внутренней стенке пробирки (пакетик не должен касаться кислоты!).
8. Плотно прикрепите пробирку с кислотой и пакетиком к резиновой пробке на приборе и передвижением бюретки 2 установите в бюретках одинаковый уровень воды, после чего снимите показания V 1(нач.) и V 2(нач.) (отсчет производите по нижнему мениску воды с точностью до 0,1 мл!).
9. Встряхните пробирку, и металл попадет в кислоту. Тотчас начинается выделение водорода и вода вытесняется из бюретки 1 в бюретку 2. Когда весь металл растворится, прекратится повышение уровня воды в бюретке 2. После охлаждения прибора до комнатной температуры (через 10-15 мин.) следует снова установить одинаковый уровень воды в бюретках (чтобы привести газ к атмосферному давлению), поле чего снимите показания V 1(конеч.) и V 2(конеч.).
Экспериментальные данные
Масса металла m, г.
Показания до проведения реакции V 1(нач.) и V 2(нач.), мл.
Показания после проведения реакции V 1(конеч.)и V 2(конеч.), мл.
Объем выделившегося водорода V (H2) = V конеч. – V нач., мл.
Температура опыта t, оC и T, K.
Атмосферное давление P, мм рт. cт.
Парциальное давление водорода p (H2) = P – p (H2O).
Давление насыщенного пара воды p (H2O) находят по таблице.
Давление насыщенного водяного пара при различных температурах
| t, 0С | p (H2O), мм рт. ст. | t, 0С | p (H2O), мм рт. ст. | t, 0С | p (H2O), мм рт. ст. | t, 0С | p (H2O), мм рт. ст. |
| 9,8 | 12,8 | 16,5 | 21,1 | ||||
| 10,5 | 13,6 | 17,5 | 22,4 | ||||
| 11,2 | 14,5 | 18,5 | 23,8 | ||||
| 12,0 | 15,5 | 19,8 |
Поправка на парциальное давление водяных паров вводится в расчет на том основании, что газ собирается над водой, и, следовательно, общее давление в системе является суммой парциальных давлений водорода и паров воды.
Расчетная часть
Для вычисления значения молярной массы эквивалента металла необходимо объем водорода, измеренный в условиях проведения эксперимента, привести к нормальным условиям, используя объединенный газовый закон:
 , (5)
, (5)
где V 0, P 0, T 0 – объем газа, давление и температура при нормальных условиях; V, P, T – объем газа, давление и температура в условиях эксперимента.
P 0 = 1атм = 760 мм рт. ст. = 101,325 кПа;
T 0 = 273 K (t 0 = 0 0C).
Выразим из формулы объединенного газового закона V 0:
 . (6)
. (6)
Для расчета молярной массы эквивалента неизвестного металла воспользуйтесь законом эквивалентов в следующем виде:
 , (7)
, (7)
откуда
 . (8)
. (8)
После расчета молярной массы эквивалента металла по результатам проведенного опыта надо идентифицировать металл по его молярной массе. Для этого по формуле:
 (9)
(9)
рассчитайте молярную массу металла, выяснив у преподавателя валентность (B) исследуемого металла.
По таблице Д. И. Менделеева выберите металл, проявляющий соответствующую валентность, для которого расхождение с табличными данными не превышает 1-2 г/моль.
После этого рассчитайте теоретическое значение молярной массы эквивалента металла:
 . (10)
. (10)
Сравните полученное (экспериментальное) значение молярной массы эквивалента металла с теоретическим и вычислите абсолютную (∆) и относительную (δ) погрешность определения по формулам:
 ; (11)
; (11)
 . (12)
. (12)
Проведение опыта и его результаты необходимо оформить в лабораторном журнале в следующем порядке:
- наименование работы;
- схема прибора;
- ход экспериментального определения молярной массы эквивалента активного металла;
- экспериментальные данные;
- расчетная часть;
- вывод.
Контрольные вопросы и задачи
1. Что такое эквивалент, молярная масса эквивалента и фактор эквивалентности?
2. Сформулируйте закон эквивалентов.
3. Как вычисляют молярные массы эквивалентов элементов, оксидов, кислот, оснований и солей?
4. Что такое молярный объем эквивалента? Чему равен при н. у. эквивалентный объем кислорода; водорода?
5. Определите молярную массу эквивалента азота, серы и хлора в соединениях NH3, H2S и HCl.
6. Вычислите молярную массу эквивалента азотной кислоты, гидроксида бария, сульфата железа (III), хлорида алюминия, нитрата цинка, сульфита магния, сульфида калия.
7. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определите молярную массу эквивалента металла.
8. При взаимодействии 5 г металла с кислотой выделилось 0,28 г водорода при нормальных условиях. Вычислите молярную массу эквивалента металла.
9. При взаимодействии щелочного металла массой 66,5 г с водой выделился водород объемом 5,6 л водорода (н. у.). Какой это металл?
10. При растворении 0,27 г металла в кислоте выделилось 118 мл водорода при 21 0С и 101,8 кПа. Определите молярную массу эквивалента металла.
11. На нейтрализацию 1 г кислоты израсходовано 0,635 г гидроксида натрия. Вычислите молярную массу эквивалента кислоты.
12. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла.
13. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалента этого металла.
14. Может ли молярная масса эквивалента вещества иметь разные значения? Определите фактор эквивалентности серной кислоты в реакциях:
NaOH + H2SO4 = NaHSO4 + H2O,
PbCl2 + H2SO4 = PbSO4 + 2HCl.
15. Вычислите молярные массы эквивалентов Al(OH)3 в реакциях, выраженных уравнениями:
Al(OH)3 + HCl = Al(OH)2Cl + H2O,
Al(OH)3 + 3HCl = AlCl3 + 3H2O.






