Функция называется характеристической, если её частная производная по некоторому параметру даёт другой параметр, а именно, соответствующий тому, по которому производится дифференцирование.
1. Рассмотрим сопряжение по координатам.
В этом случае в качестве независимо изменяющихся параметров выступают только координаты, а потенциалы отслеживают их изменение по каким-либо зависимостям с участием этих координат.
Как известно, dU – полный дифференциал и U=U(X1, X2,…, Xn). По правилам математики для полного дифференциала функции нескольких переменных

Здесь, Xinv – означает, что все остальные координаты инвариантны, т.е. временно не являются переменными («заморожены»).
Так как  , то
, то 
Последнее равенство должно выполняться при любых k, поэтому
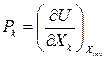 (32)
(32)
В соответствии с определением характеристической функции, U является характеристической функцией при сопряжении по координатам. Y - общее обозначение характеристической функции. Таким образом можно записать:
Y(Xk) = U (33)
Пример: Термодеформационная система.
| X | S | v |
| P | T | -p |
Из (33) для данного случая:
Y(S,v)=U (34)
Из (32) получим:
 (35)
(35)
 (36)
(36)
Так как  (37)
(37)
то для термодеформационной системы:
dU=T dS – p dv (38)
Так как TdS = dQ и PdV = dA, то уравнение (38) – это первое начало термодинамики dU = dQ – dA.
2. Рассмотрим сопряжение по потенциалам.
Без вывода, окончательно можно записать:
 (39)
(39)
 (40)
(40)
 (41)
(41)
Рассмотрим в качестве примера термодеформационную систему:
| X | S | V |
| P | T | -p |
Из (39) Y(T,p) = U – TS + pv – эта характеристическая функция в термодинамике имеет свое обозначение и название:
F = U – TS + pv (42)
где, Ф - свободная энтальпия (удельная свободная энтальпия);
По физическому смыслу pv – удельная потенциальная энергия 1 кг сжатой до давления р системы.
Из (40) dF = -S dT + v dp (43)
Из (41) =>  ;
;  .
.
В химической термодинамике свободную энтальпию называют изобарно-изотермическим потенциалом.
3. Рассмотрим смешанное сопряжение:
При таком виде сопряжения в качестве независимых переменных выступают не все n потенциалов, а только r потенциалов. Такие независимые потенциалы обозначим как Pi,
где i=1,2,3,…,r. (r < n)
Независимые координаты обозначим как Xj,
где j=(r+1),(r+2),…,n
Без вывода сразу запишем окончательные соотношения:
 (46),
(46),
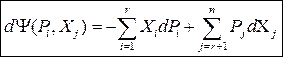 (47)
(47)
 (48)
(48)
 (49)
(49)
Пример: Рассмотрим термодеформационную систему
| X | S | V |
| P | T | -p |
а) Пусть независимым потенциалом будет – Т, а независимой координатой – v. Из (46) Y(T,v) = U – TS. Эта характеристическая функция в термодинамике имеет свое обозначение и название F = U – TS (50) – свободная энергия.
В соответствии с (47) запишем дифференциал этой функции:
dF = – S dТ – p dv (51)
Из (48) и (49) получим:
 (52),
(52),
 (53).
(53).
Из (51) для изотермического процесса (T=const) получим
dFT = – p dv (54)
Так как p dv = dAдеф, то в изотермических процессах деформационная работа совершается системой за счёт убыли свободной энергии.
В химической термодинамике F называется изохорно-изотермическим потенциалом.
б) Пусть независимым потенциалом будет (-p), а независимой координатой – S. В соответствии с (46) получим:
Y(p,S) = U + pv (55)
В термодинамике эта характеристическая функция имеет свое название и обозначение i = U + pv – удельная энтальпия,  .
.
Ранее указывалось, что произведение pv – это потенциальная энергия 1кг газа при давлении p с удельным объёмом v. Покажем это на следующем примере (рис.7):
|



 Обозначения:
Обозначения:
 |
М – масса груза
|
|
H S – площадь поршня
W – объем газа в цилиндре
W, m
 |
рис.7. Схема для определения физического смысла произведения PV.
В равновесии Mg = pS. Умножим обе части этого уравнения на высоту Н, помня, что объем системы W=SH:
Eпот = МgH = pSH = pW
Удельная потенциальная энергия – это Eпот /m, тогда
Eпот /m = pW/m = pV
Из соотношения (47) для термодеформационной системы получим:
di = T dS + v dp (56)
Как известно, T dS = dQ и dAпол= -VdP, тогда
di = dQ - dAпол
или dQ = di + dAпол (56*)
После интегрирования (56*) получим I-е начало термодинамики в так называемой энтальпийной форме
Q = ∆i + Aпол (56**)
Теплота, подведенная к системе, идет на увеличении ее энтальпии и на совершение системой полезной работы.
Из (56) для изобарного процесса:
dQp = dip (57)
После интегрирования получим:
Qp = i2 – i1 (58)
Таким образом, в изобарных процессах количество теплоты, которой обмениваются система и окружающая среда, равно разности значений энтальпий в конечном и начальном состояниях системы.
Из (56) для адиабатного процесса следует
dis = -dAпол или Апол = -∆is = i1 – i2
Таким образом, полезная работа в адиабатных процессах равна разности энтальпий в начальном и конечном состояниях системы.
Из (48), (49) получим:
 (59)
(59)
 (60)
(60)
Так как dY - это полный дифференциал, то все характеристические функции (F,U,Ф,i) являются функциями состояния:
ΔU = U2 – U1
ΔФ = Ф2 – Ф1
ΔF = F2 – F1
Δi = i2 – i1
Как будет показано далее, к функциям состояния относится также энтропия S.
Мнемонический приём для термодеформационной системы:
1) Записываем «четверку» параметров для термодеформационной системы, причем первыми идут параметры теплового взаимодействия (S и Т).

2) пропускаем «шампуры» через параметры «соседнего» взаимодействия
3) пишем «по-японски» вертикально «FUФi»
4) дописываем к каждой из «FUФi» параметры «на шампурах»
5)в правой части дифференциалов характеристических функций сначала пишем дифференциалы параметров «на шампурах»
6) дописываем сомножители к этим дифференциалам, стоящим в правой части по правилу: «каждой твари по паре»
7) расставляем знаки по правилу: «послушай женщину и сделай наоборот». Если в произведении первой стоит координата, то знак меняется на противоположный естественному.
 |

|



По своей сути, формулы (61) – это первое начало термодинамики для термодеформационной системы в различных формах записи.
8) выражаем параметры в правой части уравнений (61) не стоящие под знаком дифференциала по правилу: «если очень хочется, то можно»


и так далее.






