Мета модуля – формування уявлень про електрохімічні системи, процеси, що в них протікають і їх характеристики.
За модулем студенти повинні вміти:
– Визначати ступені окиснення елементів у сполуках. Розпізнавати процеси окиснення та відновлення. Зрівнювати рівняння реакцій методом електронного балансу.
– Складати схеми гальванічних елементів, обчислювати електрорушійну силу за стандартних та інших умов.
– Складати схеми катодних і анодних процесів електролізу розплавів і розчинів електролітів.
– Розв’язувати задачі із застосуванням закону Фарадея.
– Характеризувати корозійні процеси та описувати їх за допомогою хімічних рівнянь.
Література: [1] c.156-207, [2] c. 285-330, [3] c. 241-283, [4] c. 54-59, 199-211, [5] c. 234-247, [6] c. 6-25.
Лабораторна робота № 4
Окисно-відновні реакції
Мета роботи: простежити за ходом окисно-відновних реакцій, скласти рівняння реакцій і зрівняти методом електронного балансу, визначити окисник та відновник.
Дослід 1. У розчин купрум (II) сульфату опустіть на 3-5 хвилин залізний цвях, поверхня якого очищена наждаковим папером. Опишіть спостереження в ході реакції. Складіть рівняння реакції і зрівняйте методом електронного балансу.
________________
Дослід 2. До 2 крапель розчину калій йодиду долийте 2 краплі розчину сульфатної кислоти Н2SО4 і 2 краплі розчину калій йодату КIО3. Опишіть спостереження в ході реакції. Складіть рівняння реакції і зрівняйте методом електронного балансу. Доведіть наявність вільного йоду за взаємодією з крохмалем.
________________
Дослід 3. До 2 крапель розчину калій дихромату К2Сr2О7 додайте 2 краплі розведеної сульфатної кислоти і 2 краплі розчину калій нітриту КNO2. Опишіть спостереження в ході реакції. Складіть рівняння реакції і зрівняйте методом електронного балансу.
________________
Дослід 4. У 3 пробірки налийте по 1 краплі розчину калій перманганату КМnО4. У першу пробірку додайте 2-3 краплі розчину сульфатної кислоти, у другу – дистильованої води, у третю – 4 краплі розчину натрій гідроксиду. В усі пробірки додайте кристалічний натрій сульфіт. Опишіть спостереження в ході реакцій. Складіть рівняння реакцій і зрівняйте методом електронного балансу.
______________
______________
______________
Дослід 5. Визначення напрямку окисно-відновної реакції:
Сr(NО3)3 + К2SО4 + I2 + H2O = К2Сr2О7 + КI + Н2SО4 + КNО3.
а) Внесіть в пробірку по 2 краплі хром (III) нітрату, калій сульфату і додайте до них 1-2 краплі розчину йоду. Чи відбувається окиснення хрому (III) йодом, що повинно супроводжуватися знебарвленням йоду?
б) Внесіть в пробірку по декілька крапель розчину калій дихромату і сульфатної кислоти, потім додайте 3-4 краплі калій йодиду. Опишіть спостереження в ході реакцій. Визначте, у прямому чи зворотному напрямку протікає окисно-відновна реакція?
______________
Завдання для самоконтролю до теми
"Окисно-відновні реакції"
1. Які реакції називаються окисно-відновними?
2. Вкажіть типи окисно-відновних реакцій.
3. Які речовини в окисно-відновних реакціях називаються відновниками, а які – окисниками?
4. Визначте ступінь окиснення Сr в наступних сполуках: К2СrО4, Сr2О3, Fе(СrО2)2, К2Сr2О7, Сr2(SО4)3.
5. Вкажіть, які із приведених процесів являють собою окиснення, а які – відновлення: S → SO 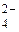 ; S → S
; S → S  ; Sn → Sn
; Sn → Sn  ; К → К+; Вr2 → 2Вr
; К → К+; Вr2 → 2Вr  ; 2Н+ → Н2; Н2 → 2Н–; СI– → СIО
; 2Н+ → Н2; Н2 → 2Н–; СI– → СIО  ; V2+ → VO3–; IО
; V2+ → VO3–; IО  → I2 ; МnО
→ I2 ; МnО  → МnО
→ МnО 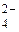 .
.
6. Дорівняйте реакції методом електронного балансу. До якого типу окисно-відновних реакцій відносяться рівняння?
а) КМnО4 + КОН → К2МnО4 + О2 + Н2О;
б) NН4NО2 → N2 + Н2О;
в) NаОН + S → Nа2S + Nа2SО3 + Н2О;
г) Р + КОН + Н2О → РН3 + КН2РО2;
д) Н2О2 → О2 + Н2О;
є) КМnО4 + МnSО4 + Н2О → МnО2 + К2SО4 + Н2SО4;
е) Zn + HNO3 → Zn(NO3)2 + N2O + H2O;
ж) NH4NO3 → N2O + H2O;
з) H2S + HNO3 → S + NO2 + H2O;
і) Аg + HNO3 → AgNO3 + NO2 + H2O.
7. Закінчіть і зрівняйте рівняння реакцій, вкажіть окисник і відновник:
а) Мn(ОН)2 + Сl2 + КОН → МnО2 +...
б) МnО2 + О2 + КОН → К2МnО4 +...
в) РbS + НNО3 → РbSО4 + NО2 +...
г) КМnО4 + FeSО4 + Н2SО4 →
д) К2Cr2О7 + НCl →
е) Н2S + К2Cr2О7+ Н2SО4 →.
Лабораторна робота № 5
Гальванічні елементи
Мета роботи: визначити дослідним та розрахунковим методами ЕРС гальванічних елементів, обчислити відносну похибку досліду.






