Всасывание происходит также при участии желчных кислот, которые образуют вместе с моноацилглицеринами, холестерином и жирными кислотами смешанные мицеллы - растворимые комплексы, обеспечивающие переход продуктов гидролиза в клетки слизистой кишечника.
Желчные кислоты с током крови доставляются в печень, затем снова секретируются желчью в кишечник, то есть повторно используются, циркулируя по кругу: печень - кишечник - печень. Однако в течение суток примерно 0,3 г желчных кислот не всасываются, а выводятся с калом. Потери восполняются за счет синтеза в печени из холестерина.
Ресинтез триацилглицеринов из продуктов расщепления происходит в клетках слизистой кишечника: В процессе ресинтеза происходит образование жиров, близких по составу к жирам организма.
Транспорт ресинтезированного жира через лимфатическую систему и кровоток возможен только после включения его в состав липопротеинов. В кишечнике образуются два типа липопротеинов: хиломикроны - ХМ и в небольшом количестве липопротеины очень низкой плотности - ЛОНП. В составе хиломикронов экзогенные жиры доставляются в органы и ткани. Образовавшиеся в энтероцитах липопротеины представляют собой незрелые хиломикроны, которые сначала попадают в лимфу путем экзоцитоза. Через нее они попадают в большой круг кровообращения, минуя печень. В крови незрелые хиломикроны получают другие апопротеины — C-II и Е и превращаются в зрелые хиломикроны. Хиломикроны являются короткоживущими частицами, полупериод жизни которых составляет 0,5—2 ч. (рис. 4)
Липопротеинлипаза (ЛП-липаза) - фермент, обеспечивающий потребление экзогенных жиров тканями. ЛП-липаза, располагающаяся в эндотелии сосудов, взаимодействует с хиломикронами кровотока и гидролизует триацилглирины на глицерин и жирные кислоты, которые поступают в клетку. По мере извлечения ТАГ из хиломикронов последние превращаются в остаточные хиломикроны и затем поступают в печень (рис.3). В жировой ткани из продуктов гидролиза триацилглицеринов снова происходит ресинтез жира (второй), и он депонируется там, пока не будет востребован.
Потребность в жирах составляет 50-100 г. в сутки - в зависимости от характера питания и энергетических затрат.
| нспортная функция липопротеинов |
Рисунок 4
Основные события и локализация переваривания и всасывания жиров представлены на рисунке 5.
Депонирование и мобилизация жиров
Источники жира в организме: 1. пищевой жир (экзо генный): 2. эндогенный жир, синтезируется в печени из углеводов.
Жиры, как и гликоген, являются формами депонирования энергетического материала. Причем жиры - наиболее долговременные и более эффективные источники энергии. Если поступление жира превышает потребности организма в энергии, то жир депонируется в адипоцитах. Кроме того, если количество поступающих углеводов больше, чем надо для депонирования в виде гликогена, то часть глюкозы также превращается в жиры. Таким образом, жиры в жировой ткани накапливаются в результате трех процессов:
1. поступают из хиломикронов, которые приносят экзогенные жиры из кишечника
2. поступают из ЛОНП, которые транспортируют эндогенные жиры, синтезированные в печени из глюкозы
3. образуются из глюкозы в самих клетках жировой ткани.
В первом и во втором случае жиры в составе липопротеинов гидролизуются ЛП-липазой и в клетку поступают жирные кислоты, которые затем используются для синтеза ТАГ. Синтез эндогенного жира из углеводов протекает в печени и в жировой ткани.
ЛИПОГЕНЕЗ.
Синтез жиров и в печени, и в жировой ткани происходит через образование фосфатидной кислоты, однако в печени глицерофосфат образуется двумя путями:

Рисунок 5.
1. Путем активации глицерина с помощью глицеринкиназы (глицеролкиназы).
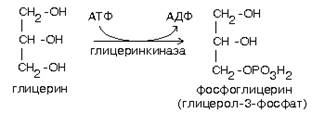
Эта реакция характерна для глицерина, попадающего в печень из крови.
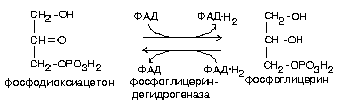
2. Путем восстановления фосфодиоксиацетона, полученного при распаде глюкозы.
Кроме глицерина, для синтеза нейтрального жира необходимы жирные кислоты в активной форме. Активная форма любой жирной кислоты – Ацил-КоА. Образуется при участии фермента ацил-КоА-синтазы.

Здесь наблюдается глубокий распад АТФ до АМФ. АМФ не может вступить в окислительное фосфорилирование. Поэтому существует реакция: АТФ + АМФ Þ 2АДФ. Поэтому затраты на активацию молекулы жирной кислоты эквивалентны затрате двух АТФ. Следующим этапом на пути синтеза жира является реакция образования фосфатидной кислоты:

Реакция катализируется ключевым ферментом липогенеза – глицерол-3-фосфатацилтрансферазой. Для этого фермента нет аллостерических эффекторов, но обнаружен адипсин (ацилстимулирующий белок), который облегчает взаимодействие Ацил-КоА с ферментом. Адипсин является продуктом протеолиза одного из компонентов системы комплемента. Относится к гормонам местного действия, так как вырабатывается в жировой ткани и действует там же.
Две последующие реакции являются завершающими в синтезе триацилглицерина.

В жировой ткани источником глицерол-З-фосфата может быть только диоксиацетонфосфат, поэтому в адипоцитах обязательно должен происходить гликолиз, который поставляет диоксиацетонфосфат, превращающийся в глицерин (рис. 6)

Рисунок 6
Реакции синтеза не зависят от того, каково происхождение веществ – участников реакций.
Жиры, синтезированные в печени, упаковываются в ЛОНП (липопротеины очень низкой плотности) и секретируются в кровь. ЛОНП содержат апопротеины В-100, C-II, Е. Жиры, транспортируемые ЛОНП, подвергаются гидролизу под действием липопротеинлипазы в разных тканях, особенно активно в капиллярах крови жировой ткани. Жирные кислоты проходят в клетки и используются в разных тканях по-разному: в адипоцитах для синтеза жиров, в миокарде, скелетных мышцах окисляются, образуя АТР, необходимый для работы этих тканей.
Активность липопротеинлипазы повышается в абсорбционный период под действием инсулина, когда в адипоцитах происходит синтез жиров, в котором используются как жирные кислоты, поступающие из крови, так и жирные кислоты, синтезированные непосредственно из продуктов распада глюкозы
После еды при повышении концентрации глюкозы в крови увеличивается секреция инсулина. Инсулин активирует: 1)транспорт глюкозы внутрь адипоцитов (ГЛЮТ-4); 2) липопротеинлипазу, ее синтез в адипоцитах и экспонирование на поверхности стенки капилляра. Жирные кислоты проникают в адипоцит, а глицерин транспортируется в печень. Так как в адипоцитах нет фермента глицеролкиназы, то свободный глицерин не может использоваться для синтеза ТАГ в этой ткани.
Активированные жирные кислоты взаимодействуют с глицерол-3-фосфатом, образующимся из диоксиацетонфосфата, и через фосфатидную кислоту превращаются в ТАГ, которые депонируются в адипоцитах (рис.7).

Рисунок 7






