Обнаружение Ca2+
а) к 1-2 каплям раствора CaCl2 добавьте 1-2 капли раствора (NH4)2C2O4. Наблюдайте помутнение раствора вследствие образования Са2С2О4;
б) на предметном стекле поместите каплю раствора CaCl2 и добавьте каплю 2 н раствора H2SO4; слегка упарьте до появления каемки по краям капли. Образовавшиеся кристаллы рассмотрите в микроскоп. Сделайте выводы. Сравните с рис. 12;
|

в) к 1-2 каплям раствора соли кальция СаCl2 добавьте по капле раствор NH4OH и NH4Cl, нагрейте и осадите примерно равным объёмом насыщенного раствора K4[Fe(CN)6]. Проверьте растворимость осадка в 2 н уксусной кислоте.
Обнаружение Mg2
а) к капле раствора MgCl2 или MgSO4 добавьте каплю 5%-го аммиачного раствора оксихинолина. Наблюдайте образование зеленоватого осадка оксихинолината магния;
б) к одной капле раствора MgCl2 добавьте I каплю NH4Cl и кристаллик Na2HPO4. Наблюдайте образование характерного кристаллического осадка MgNH4PO4. Рассмотрите кристаллы в микроскоп. Сравните с рис. 13.
|

Обнаружение Cl– К капле NaCl добавьте 1 каплю раствора AgNO3. Наблюдайте образование осадка.
Обнаружение SO42– К 1 капле Na2SO4 добавьте 1 каплю раствора BaCl2. Что наблюдается?
Обнаружение CО32 – К 1 капле Na2CO3 добавьте каплю концентрированной HCl. Какой газ выделяется?
Обнаружение S2– К 1 капле раствора сульфида натрия добавить 1 каплю соли свинца. Объясните наблюдаемое явление.
Выполнение работы. Используя соответствующие реактивы, проделайте качественные реакции на ионы Са2+, Mg2+, SO42_, CO32_, S2_, Cl_. Все реакции выполняйте на часовых или предметных стеклах. Запишите уравнения в молекулярном и ионном виде. Составьте таблицу по форме:
| Изучаемые ионы | Используемые реактивы | Цвет и структура осадков | |||||
| Ca2+ | |||||||
| Mg2+ | |||||||
| SO42– | |||||||
| CO32– | |||||||
| S2– | |||||||
| Cl– |
В соответствующую клеточку впишите формулу вещества, отметьте цвет и структуру осадка (плотный, рыхлый, мелкокристаллический, хлопьевидный и т.д.).
18.4. Лабораторная работа «Химиический анализ состава пластовой воды»
Перед началом анализа определяют плотность пластовой воды. Если она меньше 1,05 г/см, то воду разводят в соотношении 1:10, если больше – в соотношении 1:50. Определение повторите 2-3 раза, запишите результаты в таблицу и рассчитайте среднее значение.
Определение гидрокарбонат-иона HCO3- (рН от 4,4 до 8,4)
В коническую колбу отмерьте цилиндром 100 мл исследуемой воды, добавьте 2-3 капли метилоранжа и оттитруйте 0,1 н раствором НС1 до оранжевой окраски индикатора. Содержание HCO3– рассчитывается по формуле
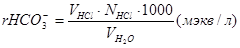
Результаты определений запишите в таблицу.
Разбавление =; NHCl =
| Номер опыта | VHCl, мл | Содержание HCO3 – | |
| мэкв/л | мг/л | ||
| 1. 2. 3. | |||
| Среднее: |
С учетом разбавления: rHCO3 –= мэкв/л; [ НСO3 –] = мг/л
Определение CO32– и HCO3– при совместном их присутствии (рН от 8,4 до 12,4)
В коническую колбу отмерьте цилиндром 100 мл воды, прибавьте
5 капель 1%-ного раствора фенолфталеина и титруйте 0,1 н раствором НСl (осторожно, по каплям!) до обесцвечивания. Запишите объём кислоты, пошедшей на титрование (V1). Затем к этому же раствору добавьте 3 капли
0,1 %-ногометилоранжа и титруйте тем же децинормальным раствором НС1 до перехода желтой окраски в оранжевую.
Запишите общий объём кислоты, пошедшей на титрование (Vобщ.). Если в растворе были только ионы CO32–, то Vобщ.=2V1. Если присутствуют ионы HCO3–, то Vобщ.>2V1. Разница (Vобщ.–2V1) соответствует количеству гидрокарбонат-ионов, следовательно:
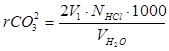 ,
,
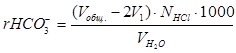 ,
,
где г:  – содержание ионов
– содержание ионов 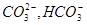 в пластовой
в пластовой
воде, мэкв/л.
Результаты внесите в таблицу:
разбавление =; NHCl =
| Номер опыта | V1 | Vобщ. | Vобщ.–2V1 | Содержание Н 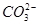
| |||
| мэкв/л | мг/л | мэкв/л | мг/л | ||||
| 1. 2. 3. | |||||||
| среднее: |
с учетом разбавления: 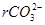 = мэкв/л;
= мэкв/л; 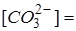 мг/л;
мг/л;
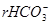 = мэкв/л;
= мэкв/л; 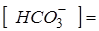 мг/л;
мг/л;
Определение Ca2+. В колбу для титрования отмерьте 50 мл пластовой воды. Прилейте 5-7 мл 2 н раствора NaOH и добавьте ложечкой сухой индикатор – мурексид до получения розовой окраски. Оттитруйте трилоном Б до светло-сиреневой окраски. Выполните 2-3 измерения. Рассчитайте содержание ионов Сa2+ по формуле 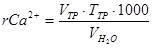 (мэкв/л).
(мэкв/л).
Результаты внесите в таблицу:
| Номер опыта | VТР, пошедший на титрование, мл | Содержание Ca2+ | |
| мэкв/л | мг/л | ||
| 1. 2. | |||
| среднее: |
разбавление:; NТР =
с учетом разбавления 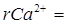 мэкв/л
мэкв/л
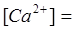 мг/л
мг/л
Определение Mg2+. В коническую колбу для титрования отмерьте цилиндром 50 мл пластовой воды. Прилейте 5-10 мл аммиачного буфера и добавьте индикатор-хромоген черный – на кончике микрошпателя до получения винно-красной окраски. Оттитруйте трилоном Б до появления чисто синей окраски раствора. Выполните измерение 2-3 раза. Рассчитайте содержание ионов Ca2+ и Mg2+ (то есть общую жесткость) по формуле
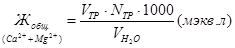
Теперь титрованием пробы воды в присутствии мурексида в щелочной среде (методика описана в предыдущем опыте) определите содержание ионов Са2+. Концентрацию ионов Mg2 + вычисляют по разности:
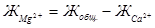 (мэкв/л)
(мэкв/л)
Результаты впишите в таблицу.
| Номер опыта | VТР., мл | Суммарное содержание ионов 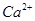 и и 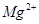 , мэкв/л , мэкв/л
| Содержание ионов 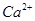
| Содержание ионов 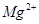
| |||
| мэкв/л | мг/л | мэкв/л | мг/л | ||||
| 1. 2. 3. | |||||||
| среднее: |
Разбавление =; NТР =
С учетом разбавления: 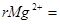 (мэкв/л);
(мэкв/л); 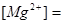 (мг/л)
(мг/л)
Определение SO42–. Получите у лаборанта 100 мл приготовленной пробы пластовой воды. Разделите пробу на две равные части по 50 мл. Одну часть поставьте греть на плитку, а другую часть, после добавления 5-10 мл буферной смеси и хромогена черного, оттитруйте 0,05 н раствором трилона Б. Запишите объём трилона, пошедшего на титрование (V1). К нагретой пробе добавьте 7 мл (Vисх .) 0,05 н раствора ВаСl2 и нагревайте ещё 15-20 минут (для более полного осаждения BaSO4). Выпавший осадок отфильтруйте через плотный фильтр и промойте осадок на фильтре небольшим количеством горячей дистиллированной воды. К фильтрату добавьте 5-10 мл аммиачного буфера, хромоген черный и оттитруйте трилоном. Запишите объём трилона, пошедшего на титрование в этом случае (V2). Зная разность (V2–V1)= VТР, можно рассчитать объём BaCl2, прореагировавшего с этим объёмом трилона:
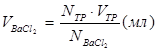
Теперь рассчитайте объём BaCl2 (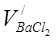 ), прореагировавший с ионами
), прореагировавший с ионами 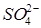 , содержащимися в пробе пластовой воды:
, содержащимися в пробе пластовой воды:
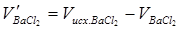
Произведение 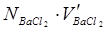 равно числу эквивалентов ионов
равно числу эквивалентов ионов 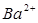 , а следовательно, и числу эквивалентов ионов
, а следовательно, и числу эквивалентов ионов 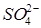 (согласно закону эквивалентов). Рассчитайте концентрацию ионов
(согласно закону эквивалентов). Рассчитайте концентрацию ионов 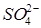 в мэкв/л по формуле
в мэкв/л по формуле
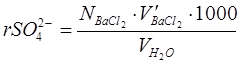 ,
,
где 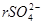 – содержание иона
– содержание иона 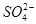 в пробе, мэкв/л;
в пробе, мэкв/л;
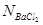 – нормальность раствора BaCl2,
– нормальность раствора BaCl2,
 – объём пластовой воды, мл;
– объём пластовой воды, мл;
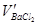 – объём раствора BaCl2, пошедший на образование осадка
– объём раствора BaCl2, пошедший на образование осадка
BaSO4, мл.
Результаты внесите в таблицу.
Разбавление=; 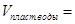 ; NТР =;
; NТР =;
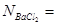 ;
; 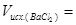 .
.
| V1, мл, (ТР) | V2, мл, (ТР) | V2–V1, мл, (ТР) | 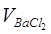 ,мл ,мл
| 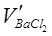
| Содержание 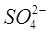
| |
| мэкв/л | мг/л | |||||
С учетом разбавления: мэкв/л
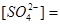 мг/л
мг/л
Определение иона Cl–. Отмерьте цилиндром 50 мл приготовленной пробы пластовой воды. Перелейте приготовленную пробу в колбу для титрования, добавьте несколько (5-7) капель 10%-ного раствора индикатора-нитропруссида натрия и титруйте раствором нитрата ртути (II) на черном фоне до появления устойчивой белой мути. Это свидетельствует о появлении избытка ионов Hg2 +, которые с нитропруссидом натрия образуют труднорастворимый осадок белого цвета. Титрование повторите 2-3 раза и возьмите среднее значение Vср. Определение точки эквивалентности в данном случае несколько запаздывает в связи с трудной диссоциацией солей ртути в растворе. Поэтому необходимо сделать поправку на титрование. Для этого оттитруйте 100 мл дистиллированной воды с 8-10 каплями нитропруссида натрия (объём нитрата ртути, пошедшего на титрование, обозначьте через ΔV). Рассчитайте содержание иона Cl– в пробе по следующей формуле:
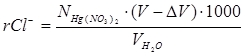 ,
,
где 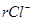 – содержание иона Сl –, мэкв/л;
– содержание иона Сl –, мэкв/л;
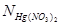 – нормальность нитрата ртути (II), экв/л.;
– нормальность нитрата ртути (II), экв/л.;
V – объём Hg(NO3)2, пошедший на титрование, мл;
ΔV – поправка на титрование.
Результаты впишите в таблицу.
разбавление =; Vпласт. воды=; 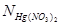 =
=
| Номер опыта | 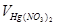 , мл , мл
| ΔV, мл | Содержание иона Cl– | |
| мэкв/л | мг/л | |||
| 1. 2. |
С учетом разбавления: 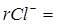 (мэкв/л);
(мэкв/л); 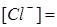 мг/л.
мг/л.
Определение ионов K+, Na+. Суммарное содержание ионов (K++Na +) вычислите как разность cумм концентраций анионов (А) и катионов (К), выраженных в эквивалентной форме: 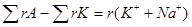 .
.
Для пересчета содержания (K++Na +) из эквивалентной формы в мг/л следует величину эквивалентной формы умножить на эмпирический коэффициент: для простых вод он равен 25, для минерализованных – 24.
Результаты химического анализа пластовой вода внесите в сводную таблицу.
| Концентрация ионов | Катионы | Анионы | |||||
| Ca2+ | Mg2+ | Na++K+ | Cl– | SO42– | HCO3– | CO32– | |
| мэкв/л | |||||||
| мг/л р-ра | |||||||
| мг/100 г р-ра | |||||||
| мэкв/л |
Полученные данные используйте для классификации пластовой воды по Сулину определите тип, группу, подгруппу.
ЗАДАЧИ И УПРАЖНЕНИЯ
Методика решения задач по теме "Жесткость воды и методы её умягчения" основана на понятии жесткости, знании единиц измерения жесткости, методов умягчения воды и некоторых общих формул.
Единой международной единицы измерения жесткости не существует. Различные страны условно принимают свои единицы. В нашей стране жесткость выражают в мг-эквивалентах ионов Са2+ и Mg2+ (либо соответствующих солей кальция и магния), содержащихся в I л воды; I мг-эквивалент жесткости соответствует 20,04 мг Са2+ в I л воды или 12,16 мг Mg2+ в I л воды. В других странах жесткость воды измеряют градусами жесткости:
немецкие градусы I° = I г СаО в 100 л воды
французские I° = I г СаСО3 в 100 л воды
английские I° = I г СаСО3 в 70 л воды
Например, один немецкий градус жесткости соответствует содержанию
I г СаО в 100 л воды. Содержание других металлов пересчитывается на количество эквивалентов СаО. Для пересчета жесткости, выраженной в мг-экв/л в градусы жесткости других стран можно воспользоваться следующими соотношениями (ориентировочно):
I мг-экв /л = 2,8° (немец.) = 5° (франц.) = 3,5° англ.) = 50° (американ.).
Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле
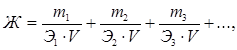
где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
Э1, Э2, Э3 – эквивалентные массы ионов металлов (или их солей), мг/экв;
V – объём воды, л.
Временную жесткость воды можно определить по объёму кислоты, пошедшей на её титрование. В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Следовательно:
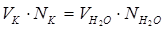 ,
,
где 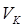 – объём кислоты, пошедшей на титрование, мл;
– объём кислоты, пошедшей на титрование, мл;
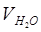 – объём пробы воды, взятой для титрования, мл;
– объём пробы воды, взятой для титрования, мл;
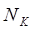 – нормальная концентрация кислоты, экв./л;
– нормальная концентрация кислоты, экв./л;
Отсюда:
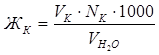 (мэкв/л).
(мэкв/л).
Аналогично можно рассчитать общую жесткость воды (Жобщ.) по объёму трилона Б, пошедшего на титрование:
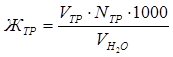 (мэкв/л).
(мэкв/л).
Эквивалент трилона Б равен 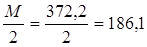 г
г
Для устранения жесткости на практике часто используется известково-содовый метод. Добавление к воде Ca(OH)2 устраняет карбонатную жесткость (ЖК), а добавление (Na2CO3) – некарбонатную жесткость (ЖНК).
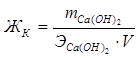 ;
; 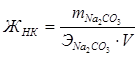 ;
;
 .
.
Иногда при умягчении воды известково-содовым методом дозы извести и соды, вводимые в воду, определяются пробным умягчением. Для ориентировочных расчетов можно использовать следующие формулы:
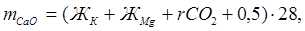
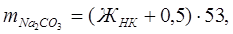
где 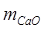 и
и 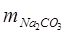 – содержание извести и соды, мг/л;
– содержание извести и соды, мг/л;
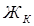 – карбонатная жесткость, мэкв/л;
– карбонатная жесткость, мэкв/л;
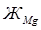 – магниевая жесткость, мэкв/л;
– магниевая жесткость, мэкв/л;
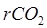 – содержание диоксида углерода, мэкв/л;
– содержание диоксида углерода, мэкв/л;
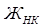 – некарбонатная жесткость, мэкв/л;
– некарбонатная жесткость, мэкв/л;
0,5 – избыток реактива, мэкв/л;
28 – масса мг-эквивалента оксида кальция, мг;
53 – масса мг-эквивалента соды, мг.
Широкое применение для умягчения воды нашли ионообменные смолы. В этом случае расчеты обычно связаны с определением обменной емкости (ε) ионитов. Обменной емкостью катионита называют максимальное количество ионов (в мэкв/г и мэкв/л), поглощаемое I г катионита обменным путем. Рассчитывают ε из соотношений:
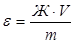 (мэкв/г),
(мэкв/г),
где V – объём воды, пропущенной через катионит, л;
m – масса катионита, г;
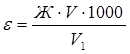 (мэкв/л),
(мэкв/л),
где Ж – жесткость воды, мэкв/л;
V – объём воды, пропущенной через катионит, л;
V1 – объём катионита, см3.






