При очистке природных и сточных вод применяют комплекс методов, в результате которых последовательно удаляются вредные примеси, находящиеся во взвешенном, коллоидном и молекулярно-растворенном состояниях. Основными методами очистки являются отстаивание, коагуляция, фильтрование, умягчение, обессоливание, дегазация, обеззараживание. После очистки иногда требуется некоторая коррекция отдельных свойств воды. Выбор методов очистки определяется составом воды и требованиями, предъявляемыми к её качеству потребителем.
Отстаивание, коагуляция, фильтрование. Грубодисперсные взвешенные частицы удаляют из воды путем простого отстаивания под действием силы тяжести или флотацией, когда вводятся пузырьки воздуха, налипающие на взвешенные частицы и флотирующие их вверх. Естественное осаждение наиболее мелких частиц, а тем более коллоидных примесей, происходит очень медленно. Для ускорения процесса осаждения систему нужно дестабилизировать, понизить её агрегативную устойчивость. Это достигается применением коагулянтов.
Большинство коллоидных частиц, содержащихся в воде (глина, кислота, гуминовая кислота, органоминеральные комплексы), обладают отрицательным зарядом. Поэтому для коагуляции этих частиц применяют такие химические реагенты (коагулянты), которые в воде образуют положительно заряженные гранулы, снижающие дзета-потенциал примесей и приводящие к их ассоциации. Для очистки воды применяют следующие коагулянты: сульфат алюминия Al2(SO4)3∙18H2O, сульфат железа FeSO4∙7H2O, хлорид железа FeCl3∙7H2O, метаалюминат натрия NaAlO2. При введении коагулянта в воду происходит его диссоциация и гидролиз:
Al2(SO4)3 → 2Al3++3SO42–
Al3+ + 3H2O  Al(OH)3+3H+
Al(OH)3+3H+
Гидроксиды алюминия или железа вследствие большого разбавления образуют коллоидные растворы, которые коагулируют под действием анионов, содержащихся в воде. На процесс коагуляции существенное влияние оказывает солевой состав воды, то есть наличие определенных анионов и катионов, которые изменяют значение дзета-потенциала.
Для увеличения степени гидролиза необходимо связывать образующиеся ионы Н +. Это достигается за счет щелочности воды – присутствия HCO3–, CO32 ––ионов. Если концентрация этих ионов невелика, то со временем коагулирование воды ухудшается. Поэтому воду перед очисткой подвергают предварительному подщелачиванию едким натром или известью, что способствует образованию гидроксидов. Создание щелочной среды способствует также очистке воды от содержащихся в ней солей железа:
FeSO4+Ca(OH)2=Fe(OH)2+CaSO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Выпадение осадка гидроксида железа начинается при рН ~ 8. Под действием заряда катиона-коагулянта происходит потеря заряда коллоидных частиц примесей и наблюдается взаимная коагуляция. Кроме того, скоагулировавшие частицы гидроксида алюминия или железа имеют чрезвычайно развитую поверхность и поэтому являются прекрасными адсорбентами для коллоидных примесей и органических веществ, содержащихся в воде. В результате коагуляции золя коагулянта и его взаимодействия с коллоидными примесями воды происходит процесс хлопьеобразования. Хлопья, оседая, увлекают с собой взвешенные частицы. Для ускорения осаждения хлопьев необходимо их укрупнение, что достигается использованием флокулянтов. В качестве флокулянтов для очистки воды используют активированную кремниевую кислоту (H2SiO3)n, природные и синтетические полимеры (крахмал, карбоксиметилцеллюлоза, гидролизованные полиакриламид и полиакрилонитрил). Образующиеся хлопья удаляются из воды отстаиванием и фильтрованием через песчаные фильтры.
Умягчение воды. Для умягчения (уменьшения жесткости) воды используют термический, реагентный методы и метод ионного обмена. Эти методы часто комбинируют.
Термический метод заключается в нагревании воды до кипения. Этим методом устраняется только карбонатная жесткость. При нагревании гидрокарбонаты разлагаются, диоксид углерода улетучивается, а карбонаты выпадают в осадок:
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
Mg(HCO3)2=MgCO3↓+CO2↑+H2O
Кипячением частично устраняется и жесткость, обусловленная наличием сульфата кальция, так как растворимость его с увеличением температуры падает.
Реагентный метод основан на переводе ионов Са2+ и Mg2+ в труднорастворимые соединения. Для осаждения солей магния и кальция применяют гашеную известь, кальцинированную соду, едкий натр, фосфаты. На практике обычно используют сочетание двух или трех реагентов, которые способствуют устранению всех видов жесткости и обеспечивают экономичность процесса.
Для устранения карбонатной жесткости воду обрабатывают гашеной известью. При этом происходит одновременное удаление ионов железа и связывание CO2. Протекающие реакции описываются следующими уравнениями:
Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O
Mg(HCO3)2+Ca(OH)2=Mg(OH)2↓+CaCO3↓+H2O+CO2↑
FeSO4+Ca(OH)2=Fe(OH)2+CaSO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
CO2+Ca(OH)2=CaCO3↓+H2O
Некарбонатная жесткость устраняется введением в воду соды Na2CO3:
CaSO4+Na2CO3=Na2SO4+CaCO3↓
MgCl2+Na2CO3=2NaCl+MgCO3↓
Более полное осаждение ионов Са2+ и Mg2+ осуществляется обработкой воды тринатрийфосфатом:
3Ca(HCO3)2+2Na3PO4=Ca3(PO4)2↓+6NaHCO3
3MgSO4+2Na3PO4=Mg3(PO4)2↓+3Na2SO4
Для повышения эффективности умягчения обработка воды реагентами сочетается с подогревом её до 95-100°С (термореагентный метод). Нагревание вызывает термический распад гидрокарбонатов (см. выше). Иногда вместо извести для умягчения воды применяется гидроксид натрия:
Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CO2+2NaOH=Na2CO3+H2O
FeSO4+NaOH=Fe(OH)2+Na2SO4
Метод ионного обмена. В больших масштабах умягчение жесткой воды проводят при помощи ионообменной сорбции, при которой сорбент поглощает из воды ионы Ca2 + и Mg2 + и обменивает на катионы, посылаемые сорбентом в раствор. Для умягчения воды применяют катиониты и аниониты. Сначала использовали неорганические иониты – преимущественно алюмосиликаты, как природные (глаукониты, цеолиты), так и искусственные (пермутиты – Na2[Al2Si2O8∙nH2O ]). Теперь они, вследствие их небольшой способности к обмену, заменены более эффективными синтетическими ионообменными смолами. Ионообменные смолы – это сетчатые, трехмерные полимеры, не растворяющиеся в воде, но ограниченно набухающие в ней и содержащие ионогенные группы, то есть группы, способные к обмену ионов.
В качестве примера полимеров, служащих основой (матрицей) для ионов, можно назвать сополимеры стирола или метакриловой кислоты с дивинилбензолом. Ионные группы вводятся в полимер или при его получении, или при последующей химической обработке полимера соединениями, содержащими необходимую ионогенную группу. Ионогенными группами у катионитов обычно служат –SO3H, –OH, –SH, –PO(OH)2. Рабочей формой катионита может быть кислотная, когда обмениваются ионы H + (Н – катионит), или солевая, например, натриевая, когда способными к обмену катионами ионита будут ионы Na+ (Na – катионит). Аниониты содержат основные группы, такие как –NH2, –NH2OH, –NHR, –NR2. Умягчение воды чаще всего проводят фильтрованием через слой Na – или H – катионитов. Применяя Na –катионит (общая формула – NaR, где R – остальная часть катионита), уравнения реакции обмена, протекающих при пропускании через него воды, можно представить следующим образом:
2NaR+Ca2+=CaR2+2Na+
2NaR+Mg2+=MgR2+2Na+
Таким образом, ионы кальция и магния переходят из раствора в катионит, а ионы натрия или водорода – из катионита в раствор, жесткость при этом устраняется. При использовании Na -катионита повышается щелочность воды, в случае использования Н-катионита повышается кислотность, вода становится коррозионно-агрессивной. После использования большей части ионов Na + или H + катиониты подвергают регенерации – восстановлению его обменных свойств. Процесс регенерации представляет ту же реакцию обмена, но проводимую в обратном направлении. Na –катионитовые фильтры регенерируют раствором хлорида натрия:
CaR2+2Na+=2NaR+Ca2+
MgR2+2Na+=2NaR+Mg2+
Н–катионитовые фильтры регенерируют слабым раствором соляной или серной кислот:
CaR2+2H+=2HR+Ca2+
MgR2+2H+=2HR+Mg2+
Обессоливание воды. Метод ионного обмена может быть использован для полного удаления из воды всех растворенных в ней солей, то есть для её обессоливания (деминерализации). Сущность обессоливания заключается в последовательном пропускании воды через Н –катионитовый и ОН –анионитовый фильтры. На Н –катионитовом фильтре происходит поглощение ионов Ca2 + и Mg2 + и всех других катионов, присутствующих в воде, в результате обмена их на Н+– ионы:
HR+Na+=NaR+H+
ОН –анионит обменивает SO42–, Cl – –ионы и все другие анионы из воды на свои ОH ––ионы:
2ROH+SO42–=R2SO4+2OH–
ROH+Cl–=RCl+OH–
Выделяемые гидроксид-ионы связываются ионами Н+, полученными при катионном обмене:
ОН–+Н+=Н2О
Регенерация ОН–анионита производится раствором гидроксида натрия:
RCl+NaOH=ROH+NaCl;
RCl+OH–=ROH+Cl–
Дегазация. Процесс удаления из воды растворенных газов (H2S, CO2, O2 и др.) называется дегазацией. Дегазация может быть осуществлена физическими и химическими методами. Физические методы основаны на законе Генри-Дальтона: растворимость газа понижаетcя с увеличением температуры и понижением их парциального давления над раствором. Это достигается подогревом воды при обычном давлении и осуществлении процесса в вакуумных дегазаторах без повышения температур.
Методы химического удаления газов из воды состоят в том, что к воде добавляют вещества, способные связывать растворенные газы в новые химические соединения.
Для удаления сероводорода из воды используют окислители, например, хлор, хлорное железо:
H2S+Cl2=2HCl+S↓
2FeCl3+H2S=2FeCl2+2HCl+S↓
Выделяемая в коллоидном состоянии сера в дальнейшем подвергается коагуляции. Для связывания кислорода в воду добавляют сильные восстановители, например, сульфит натрия, гидразин:
2Na2SO3+O2=2Na2SO4
NH2NH2+O2=N2+2H2O
Химические методы удаления диоксида углерода основаны на повышении щелочности:
2CO2+Ca(OH)2=Ca(HCO3)2
CO2+NaOH=NaHCO3
Обеззараживание воды. Проводится для удаления бактерий. Этот процесс, в основном, применяется для воды, используемой для бытовых нужд. Обеззараживание осуществляется хлорированием, озонированием, действием ультрафиолетовых лучей, ультразвука. Частичное снижение бактериальной загрязненности происходит при коагулировании и фильтровании воды через песок.
Удаление из воды соединений железа. В природных водах встречаются соединения железа со степенью окисления +2 и +3. В подземных водах преимущественно содержатся соединения Fe2 + в виде гидрокарбонатов и сульфатов. Соли Fe3 + в воде подвергаются гидролизу с образованием гидроксида железа (III), который находится в воде в коллоидном состоянии. При выходе подземных железосодержащих вод на поверхность происходит окисление Fe2 + и гидролиз с образованием бурого осадка Fe(ОН)3:
4Fe(HCO3)2+O2+2H2O=4Fe(OH)3+8CO2
4FeSO4+O2+10H2O=4Fe(OH)3+4H2SO4
Вследствие этого отдельные отрасли производства, в том числе и нефтяная промышленность, при использовании воды для заводнения пластов предъявляют строгие требования к содержанию железа.
Процесс обработки воды, проводимый для снижения содержания железа, называется обезжелезиванием.
Если железо содержится в воде в виде гидрокарбоната, то его можно удалить аэрацией. Этот метод заключается в насыщении воды кислородом для окисления соединений Fe2 + и перевода их в труднорастворимый гидроксид Fe3 + Вначале эта соль в воде гидролизуется:
Fe(HCO3)2+2H2O=Fe(OH)2+2CO2↑+2H2O
Диоксид углерода удаляется дегазацией, что способствует протеканию гидролиза. При окислении кислородом воздуха гидроксид железа (II) переходит в труднорастворимый гидроксид железа (III):
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Сульфат железа (II) удаляется аэрацией воды с подщелачиванием:
FeSO4+Ca(OH)2=Fe(OH)2+CaSO4
Гидроксид железа (III) удаляют коагулированном с последующим фильтрованием.
Ионы железа можно удалить из воды и методом катионного обмена.
ОЧИСТКА СТОЧНЫХ ВОД
Очистка производственных сточных вод предназначается для удаления загрязняющих примесей, извлечения содержащихся в них ценных веществ и обеззараживания воды перед спуском в водоем. Очистке сточных вод, содержащих токсичные примеси, в настоящее время уделяется значительное внимание. Лучшим способом уменьшения содержания токсичных примесей в сточных водах промышленных предприятий является усовершенствование технологии производства.
Для удаления из сточных вод нерастворимых жидких (нефть, нефтепродукты) или твердых примесей применяется отстаивание и коагуляция с последующим фильтрованием через фильтры из песка, активированного угля. Растворимые в воде органические вещества извлекаются экстракцией малорастворимыми в воде органическими растворителями.
Для очистки сточных вод от токсичных веществ, которые находятся в виде молекул и ионов, используют также адсорбенты, иониты. Часто используют химические реагенты, превращающие растворенные токсичные примеси в нерастворимые вещества или в растворимые неядовитые.
Широко распространен биохимический метод очистки сточных вод. Метод основан на использовании микроорганизмов, превращающих органические и неорганические примеси в безвредные продукты биохимического окисления - воду, диоксид углерода, метан, сульфаты, нитраты.
ЛАБОРАТОРНЫЕ РАБОТЫ
В этот раздел включены работы по методам определения жесткости воды, методам умягчения воды, а также по качественному и количественному анализу воды.
При выполнении работ используется титриметрический (объёмный) метод анализа. Сущность его заключается в том, что количественное определение веществ осуществляется путем точного измерения объёмов растворов двух веществ, вступающих в реакцию. В основе метода лежит закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Зная нормальности (NA, NB) и объёмы (VA, VB) растворов веществ А и В, вступивших в реакцию, можно записать: NA∙VA=NB∙VB. При анализе раствор реагента (рабочий раствор) с известным титром (под титром понимают число граммов или миллиграммов растворенного вещества в I мл раствора) приливают к исследуемому раствору до тех пор, пока тем или иным способом не будет установлено, что затраченное количество реагента эквивалентно количеству определяемого вещества. Этот момент соответствует точке эквивалентности, а выполненная операция называется титрованием.
|
|
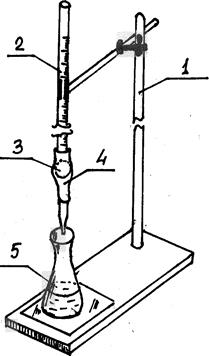
Выполнение анализа начинают с заполнения бюретки рабочим раствором (рис. 11). Нажимая на шарик, по каплям выпускают раствор из бюретки до тех нор, пока нижняя часть мениска раствора не окажется на уровне нулевого деления. Производить отсчет необходимо так, чтобы глаз находился на одном уровне с мениском. Каждое титрование следует начинать с нулевого деления. Титрование выполняют следующим образом. Коническую колбу с титруемым раствором помещают на листе белой бумаги под носиком бюретки. Кончик носика должен находиться на уровне горлышка колбы. Нажимая большим и указательным пальцами левой руки на шарик бюретки, выливают раствор в колбу небольшими порциями. Важно, чтобы нажатие производилось не по диаметру шарика, а немного сбоку в этом случае резиновая трубка отстает от шарика, пропуская раствор. Это требует минимального усилия. Недопустимо сжимать резиновую трубку ниже шарика, так как после этого в носик попадает воздух.
Добавляя раствор в колбу, правой рукой осторожно вращают колбу, непрерывно перемешивая раствор. Вблизи точки эквивалентности резко меняются некоторые свойства растворов: окраска, электропроводность и др. Раствор в колбе в зоне падения капли на короткое время приобретает окраску, характерную для точки эквивалентности. Это служит признаком приближающегося конца титрования, поэтому дальше титруют по каплям. После стойкого изменения окраски титрование прекращают и записывают показания бюретки. Титрование выполняют 2-3 раза.
18.1. Лабораторная работа «Методы определения жесткости»
Цель работы – знакомство с методами количественного определения карбонатной, некарбонатной и общей жесткости воды; освоение навыков титрования.
Определение карбонатной жесткости. Временную (или карбонатную) жесткость определяют обычно по объёму соляной (или серной) кислоты, пошедшей на титрование пробы воды. В соответствии с законом эквивалентов
 ,
,
отсюда 
где  – нормальная концентрация соли, кислоты (экв/л);
– нормальная концентрация соли, кислоты (экв/л);
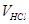 – объём кислоты, пошедшей на титрование (мл);
– объём кислоты, пошедшей на титрование (мл);
 – объём пробы исследуемой воды (мл).
– объём пробы исследуемой воды (мл).
Чтобы рассчитать величину временной жесткости, следует выразить концентрацию соли в миллиэквивалентах на I л (мэкв/л). В результате получаем формулу для расчета карбонатной жесткости (ЖК):
 .
.
Выполнение работы. В коническую колбу отмерьте 100 мл воды с неизвестной жесткостью, прибавьте 2-3 капли индикатора метилоранжа и оттитруйте 0,1 н раствором НСl до оранжевой окраски жидкости. Запишите объём кислоты, пошедшей на титрование, и рассчитайте ЖK. Объясните, что происходит при титровании,и запишите уравнения реакций.
Определение общей жесткости воды. Общую жесткость воды (Жобщ .) определяют трилонометрическим методом. Сущность метода детально описана в разделе 14.
Выполнение работы. В коническую колбу на 250 мл отмерьте цилиндром 50 мл воды с неизвестной жесткостью. Прилейте в эту колбу
5-10 мл аммиачного буфера и добавьте стеклянной ложечкой сухой индикатор – хромоген черный – до получения винно-красной окраски. Бюретку заполните 0,05 н раствором трилона Б и титруйте при постоянном перемешивании до получения чисто синей окраски раствора. Замерьте объём трилона Б и рассчитайте общую жесткость воды по формуле
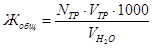 ,
,
где  – нормальность трилона Б (экв/л);
– нормальность трилона Б (экв/л);
 – объём трилона, пошедшего на титрование (мл);
– объём трилона, пошедшего на титрование (мл);
 – объем пробы воды, взятой для титрования (мл).
– объем пробы воды, взятой для титрования (мл).
Объясните химизм происходящих при титровании процессов. Сделайте вывод о степени жесткости исследуемой воды.
Определение некарбонатной жесткости. Некарбонатную жесткость воды (ЖНК) рассчитывают по разности:
ЖНК=ЖОБЩ – ЖК
18.2. Лабораторная работа «Методы умягчения воды»
Цель работы - ознакомиться с методами умягчения воды.
Термический метод. Определите карбонатную жесткость воды путем её титрования 0,1 н раствором соляной кислоты в присутствии метилоранжа (по методике, описанной на с.51). Прокипятите пробу воды в течение часа на плитке в колбе с обратным холодильником, охладите и повторно определите карбонатную жесткость. Сделайте соответствующие выводы.
Ионитный метод. Наберите в две пробирки (примерно до половины) водопроводной воды. В одну пробирку добавьте 1-2 капли метилоранжа и отметьте окраску жидкости. Во вторую – добавьте несколько капель оксалата аммония. Почему происходит помутнение раствора? Запишите уравнение реакции.
Пропустите некоторое количество водопроводной воды через колонку, заполненную катионитом. Снизу колонки отберите пробы воды в две чистые пробирки и повторите те же реакции. Почему изменилась окраска жидкости при добавлении метилоранжа? Почему не наблюдается помутнения? Что представляет собой катионит? Каков химизм происходящих процессов? Запишите уравнения реакций и сделайте выводы.
18.3. Лабораторная работа «Качественный анализ химического состава воды»
Цель работы. Изучение качественных реакций на ионы Ca2+, Mg2+, SO42–,
Cl–, CO32–, S2 – и открытие их в пробе.






