Спочатку назву ферментам давали за випадковими ознаками (тривіальна номенклатура), за назвою субстрату (раціональна), і за хімічним складом ферменту І в останній час за типом реакцій', яку вони каталізують і характером субстрату.
Наприклад, за тривіальної номенклатури деякі ферменти мали такі назви: пепсин (від грец. пепсис - шлункове травлення), трипсин (від грец. трипсис - розріджую) і папаїн (від назви дерева  із соку якого він виділений), Усі ці ферменти є протеолітичними, тобто каталізують гідроліз протеїнів (білків).
із соку якого він виділений), Усі ці ферменти є протеолітичними, тобто каталізують гідроліз протеїнів (білків).
Назви багатьох ферментів утворені із назви субстрату з добавкою суфікса -аза. Так, фермент, який прискорює реакцію гідролізу крохмалю, має назву амілаза (від грец. амилон - крохмаль), гідролаза жирів - ліпаза (від грец. ліпос - жир), протеїнів - протеаза, сечовини - уреаза (від грец. уреа - сечовина), фосфатаза - каталізує гідроліз ефірів фосфорної кислоти та ін.
Зустрічаються також назви ферментів, які вказують на характер субстрату і на тип реакції, що каталізується. Наприклад, сукциндегідрогеназа, фермент, що віднімає два атоми водню від молекули янтарної кислоти:
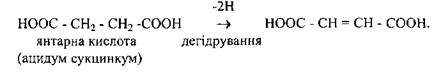
Комісія з ферментів Міжнародного біохімічного союзу в 1961 р. розробила нову систематичну класифікацію і номенклатуру реакцій, які каталізуються ферментами.
В основу класифікації ферментів покладений тип реакції, яку вони каталізують. За сучасною класифікацією всі ферменти поділяють на шість основних класів: 1) оксидоредуктази; 2) трансферази; 3) гідролази; 4) ліази; 5) ізомерази; 6) ліга-зи (синтетази).
Відповідно до наукової номенклатури (1961 р.) назва ферменту складається із хімічної назви субстрату і назви тієї реакції, яка каталізується ферментом. Так, уреаза (тривіальна назва), яка прискорює реакцію гідролізу карбаміду на діоксид вуглецю й аміак, за науковою номенклатурою називається карбамідамідогїдролазою:
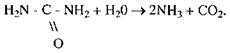
У цій назві є хімічне найменування субстрату і вказано, що фермент каталізує реакцію гідролізу амідогрупи.
За цим принципом трагелаза має назву трегалоза - 1 - глюкогідролаза.
Нова номенклатура допускає збереження поряд з новими старих робочих назв ферментів. Систематичні назви ферментів використовують тоді, коли потрібна точна ідентифікація ферменту: в наукових статтях, в оглядах і рефератах, у різних покажчиках. Більшість систематичних назв громіздка і тому Міжнародною комісією складений детальний список усіх відомих ферментів, де поряд з новою систематичною назвою кожного ферменту присвоєну стару, а також вказаний хімізм каталізованої реакції і в деяких випадках природа ферменту. Цим самим виключається можливість плутанини у назві ферментів,
Кожний фермент має у списку свій ідентифікаційний номер (шифр) і систематичну назву, яка вказує на природу хімічної реакції, яку каталізує даний фермент.
У наукових публікаціях прийнято при першому згадуванні ферменту вказувати в дужках його шифр. Наприклад, шифр уреази пишуть цифрами 3.5.1.5. Шифр абсолютно точно вказує місце ферменту в загальному списку.
Для прикладу наведено ключ до класифікації найбільш поширених ферментів -гідролаз (назву класів, кодові номери та типи реакцій, які каталізуються):
3. ГІдролази (реакції гідролізу).
3.1. Діють на складні ефірні зв'язки.
3.2. Діють на глікозидні зв'язки.
3.3. Діють на пептидні зв'язки.
3.4. Діють на С - N - зв'язки, які відрізняються від пептидних зв'язків.
3.5. Діють на кислотноангідрідні зв'язки.
Кожний клас ферментів підрозділяється на підкласи і підпідкласи в залежності від природи індивідуальних перетворень.
Перше число шифру ферменту показує, до якого із шести класів належить фермент; друге і третє вказують підклас і підпідклас відповідно; четверте число -

порядковий номер ферменту в даному підпідкласі. Такий спосіб класифікації ілюструє табл. 4.2. (із списку ферментів, який опублікований Комісією з ферментів Міжнародного біохімічного союзу).
Табл. 4.2 Приклад класифікації і номенклатури реакцій, які каталізуються ферментами
| Номер (шифр) | Систематична назва | Тривіальна назва | Реакція |
| 1. Оксидоредуктази 1.1. Діють на СН - ОН - групу донорів 1.1.1. Акцептором є НАД або Н АДФ | |||
| 1.1.1.1. | Алкоголь: НАД-оксидоредуктаза | Алкогольдегідрогеназа | Алкоголь+ НАД=Альдегід або кетон+ відновлений НАД |
| 3. Гідролази 3.5. Діють на С - N - зв'язки, які відрізняються від пептидних зв'язків 3.5.1. В лінійних амідах | |||
| 3.5.1.5. | Карбамід- амідогідролаза | Уреаза | 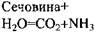
|
Оксидоредуктази
До класу оксидоредуктаз належать ферменти, які каталізують окисно-відновні реакції. У них проходить перенос електронів або атомів водню від молекули, яка окислюється (донора) до молекули, яка відновлюється (акцептора). До оксидоредуктаз належать ферменти з тривіальними назвами дегідрогеназ, редуктаз, оксидаз, пероксидаз, оксигеназ, гідроксилаз, каталази та ін.
Характерними особливостями дії оксидоредуктаз є такі: перша полягає в тому, що вони утворюють системи (так звані ланцюги окисно-відновних ферментів), у яких здійснюється багатоступеневий перенос атомів водню або електронів від первинного субстрату до кінцевого акцептора, яким є, як правило, кисень. У результаті атоми водню переносяться на кисень і утворюється вода. Ті оксидоредуктази, які переносять водень або електрони безпосередньо на атоми кисню, називаються аеробні дегідрогенази, або оксидази. Із них важливе значення мають глюкозооксидаза і поліфенолоксидаза. На відміну від них, анаеробні дегідрогенази переносять атоми водню й електрони від одного компонента окислювального ланцюга ферментів до іншого без передачі їх на кисневі атоми.
Друга особливість оксидоредуктаз полягає в тому, що вони є двокомпонентними ферментами з дуже обмеженим набором активних груп (коферментів), але
|
здатні прискорювати багато різноманітних окисно-відновних реакцій. Це досягається за рахунок того, що один і той же кофермент здатний з'єднуватися з багатьма апоферментами.
Третя особливість оксидоредуктаз як особливого класу ферментів полягає в тому, що вони прискорюють хімічні реакції, пов'язані з вивільненням енергії, яка використовується для біохімічних процесів.
Відомо більше двохсот індивідуальних оксидоредуктаз. Найбільш поширені оксидоредуктази, які мають у своєму складі в якості активної групи нікотинаміда-деніндикуклеотид (НАД) або нікотинамідаденіндинуклеотидфосфат (НАДФ). Утворений фермент-протеїд здатний віднімати від субстратів (спиртів, альдегідів, дика-рбонових і кетокислот та ін.) атоми водню, окислюючи таким чином названі сполуки. Такі фермент-протеїди (піридинпротеїди) є анаеробними дегідрогеназами.
Розглянемо механізм дії одного із піридинпротеїдів - алкогольдегідрогенази. Він складається з двох субодиниць, кожна із яких має молекулу НАД і атом цинку. У процесі відняття атому водню від спирту утворюється потрійний апофермент -кофермент-субстратний комплекс, який утримується атомом цинку. Безпосередньо від молекули спирту до НАД переходить один атом водню H+. Другий атом водню, який віднімається від молекули спирту, втрачає електрон і перетворюється в протон (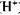 ) і поступає в реакційне середовище. Рівняння реакції окислення спирту з участю НАД має такий вигляд -
) і поступає в реакційне середовище. Рівняння реакції окислення спирту з участю НАД має такий вигляд -
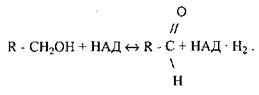
Найбільш складний і найпоширеніший варіант окислювально-відновлюваль-ного процесу в клітині полягає в окисленні атомів водню, які зняті з субстрату первинними дегідрогеназами з участю цитохромної системи. Цитохромну систему утворюють декілька оксидоредуктаз, які мають в якості простетичних груп залізо-порфірини. З'єднуючись з білками різної побудови, залізопорфірини 4 типів дають початок родині хромопротеїдів, які об'єднують загальною назвою - цитохроми. Відомо декілька десятків цитохромів. Вони є переносниками електронів.
Оксидоредуктази окислюють спирти до відповідних альдегідів, альдегідів або кетонів - до кислот, відщеплюють атоми водню від 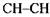 - груп з утворенням
- груп з утворенням
подвійного зв'язку, окислюють групи 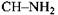 або
або  . До них належать ката-
. До них належать ката-
лаза, яка розкладає перекис водню, і піроксидаза, яка окислює за допомогою 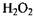 поліфеноли.
поліфеноли.

Трансферази
Ці ферменти прискорюють реакції переносу атомних груп і молекулярних залишків від одних сполук до інших. У цей клас входять більше 200 індивідуальних ферментів. У залежності від тих груп, які переносяться, розрізняють фосфотранс-ферази, амінотрансферази, глікозилтрансферази, трансферази, метилтрансферази та ін. До цього класу ферментів належать також фосфорилази, пірофосфорилази, кінази. Трансферази каталізують реакції переносу метильних, альдегідних або ке-тонних, ацильних, алкільних і глікозильних залишків, аміногруп, а також залишків фосфорної кислоти і сульфатної групи від однієї молекули до іншої.
Фосфотрансферази, які прискорюють реакцію переносу залишку фосфорної кислоти, мають виключно важливе значення для життєдіяльності організмів, бо вони забезпечують перетворення органічних сполук у фосфорні ефіри, які більш легко вступають у наступні реакції.
Трансферази беруть участь у багатьох реакціях обміну речовин.
Гідролази
До складу гідролаз відносять ферменти, які прискорюють реакції гідролізу -розщеплення складних органічних сполук за участю води, її приєднанням (катаболізм) або виділенням. Ферментативне розщеплення вуглеводів, білків, жирів проходить через ряд послідовних реакцій, які називають катаболітичним шляхом. Катаболізм супроводжується виділенням вільної енергії із складних органічних молекул, яка запасається у формі енергії фосфатних зв'язків АТФ.
Катаболізм і анаболізм проходять у клітинах одночасно, це дві сторони одного процесу - обміну речовин.
До гідролаз належать амілази, протеази, целюлази і геміцелюлази, пектинази, амідази, естерази, карбогідази,  -галактозидиза,
-галактозидиза, 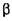 -галактозидаза,
-галактозидаза,  -фруктофура-нозидаза та ін.
-фруктофура-нозидаза та ін.
Важливе виробниче значення мають амілази - ферменти, які каталізують гідроліз крохмалю. Ці гідролази ще називають глікозидазами, бо вони беруть участь у розщепленні глікозидних зв'язків поліцукридів.
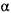 -аміліза (К.Ф.З.2.1.1.,
-аміліза (К.Ф.З.2.1.1., 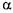 -1,4 -глюкан -4 глюканогідролаза) каталізує розрив
-1,4 -глюкан -4 глюканогідролаза) каталізує розрив 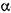 -1,4 -глюкозидних зв'язків в амілозі й амілопектині. Утворені декстрини є порівняно низькомолекулярними декстринами (5-8 глюкозних залишків). Це зумовлено тим, що фермент не діє на
-1,4 -глюкозидних зв'язків в амілозі й амілопектині. Утворені декстрини є порівняно низькомолекулярними декстринами (5-8 глюкозних залишків). Це зумовлено тим, що фермент не діє на 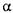 - 1,6 - глюкозидні зв'язки в місцях розгалуження амілопектину. У результаті дії
- 1,6 - глюкозидні зв'язки в місцях розгалуження амілопектину. У результаті дії 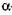 -амілази на амілозу й амілопектин утворюються низькомолекулярні декстрини, які не забарвлюються йодом, і невелика кількість олігоцукридів, мальтози і глюкози. У зв'язку з характером дії,
-амілази на амілозу й амілопектин утворюються низькомолекулярні декстрини, які не забарвлюються йодом, і невелика кількість олігоцукридів, мальтози і глюкози. У зв'язку з характером дії, 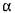 - амілазу називають дек-стриногенною або ендогенною амілазою.
- амілазу називають дек-стриногенною або ендогенною амілазою.
Дія 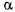 - амілази на амілозу призводить до швидкого зменшення в'язкості середовища І збільшенню відновлювальної здатності.
- амілази на амілозу призводить до швидкого зменшення в'язкості середовища І збільшенню відновлювальної здатності.
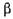 - Амілаза (К.Ф. 3.2.1.2,
- Амілаза (К.Ф. 3.2.1.2, 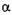 - 1,4 - глюкан-мальтогідролаза) гідролізує
- 1,4 - глюкан-мальтогідролаза) гідролізує 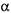 -1,4 -глюкозидні зв'язки з нередукуючих кінців ланцюга амілози й амілопектину, послі-
-1,4 -глюкозидні зв'язки з нередукуючих кінців ланцюга амілози й амілопектину, послі-
довно відщеплюючи молекули мальтози. Амілоза цим ферментом повністю розщеплюється до мальтози, амілопектин - на 50 - 55%.
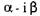 - амілази не гідролізують
- амілази не гідролізують 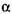 -1,6 -глюкозидні зв'язки в амілопектині. При їх спільній дії на крохмаль залишаються розгалужені декстрини з 5-8 глюкозидни-ми залишками, які називають граничними декстринами. У них зосереджені всі
-1,6 -глюкозидні зв'язки в амілопектині. При їх спільній дії на крохмаль залишаються розгалужені декстрини з 5-8 глюкозидни-ми залишками, які називають граничними декстринами. У них зосереджені всі 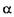 1,6 - глюгозидні зв'язки крохмалю.
1,6 - глюгозидні зв'язки крохмалю.
В амілазах мікробного походження 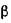 - амілаза відсутня, разом з тим
- амілаза відсутня, разом з тим  - амілаза мікроміцетів і бактерій сприяє утворенню уже на початку гідролізу значної кількості глюкози і мальтози.
- амілаза мікроміцетів і бактерій сприяє утворенню уже на початку гідролізу значної кількості глюкози і мальтози.
Оліго - 1,6-глюкозидаза {КФ 3.2.1.10; декстрин - 6 - глкжаногідролаза; дек-стриназа) присутня в солоді, каталізує розщеплення 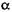 -1,6 - глюкозидних зв'язків в кінцевих декстринах, пентозах, ізомальтозі. Особливо велика кількість цих ферментів накопичується в просяному солоді.
-1,6 - глюкозидних зв'язків в кінцевих декстринах, пентозах, ізомальтозі. Особливо велика кількість цих ферментів накопичується в просяному солоді.
Глюкоамілаза (КФ 3.2.1.3; 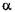 - 1,4 - глюкан - глюкогідролаза; синонім - амілог-люкозидаза) містяться в мікроорганізмах, каталізує розрив
- 1,4 - глюкан - глюкогідролаза; синонім - амілог-люкозидаза) містяться в мікроорганізмах, каталізує розрив 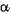 -1,4 – і
-1,4 – і 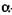 -1,6- глюкозидних зв'язків у крохмалі. Від нередукуючих кінців амілози й амілопектину послідовно відщеплюються по одному глюкозидному залишку, тобто глюкоза. Під дією цього ферменту крохмаль може гідролізуватися повністю.
-1,6- глюкозидних зв'язків у крохмалі. Від нередукуючих кінців амілози й амілопектину послідовно відщеплюються по одному глюкозидному залишку, тобто глюкоза. Під дією цього ферменту крохмаль може гідролізуватися повністю.
Целюлаза (КФ 3.2.1.4; 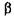 -1,4 - глюкан - 4 глюканогідролаза каталізує розщеплення
-1,4 - глюкан - 4 глюканогідролаза каталізує розщеплення 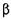 - глюкозидних зв'язків у целюлозі до целодекстринів і целобіози.
- глюкозидних зв'язків у целюлозі до целодекстринів і целобіози.
Геміцелюлаза. Під цією назвою об'єднані ферменти, які каталізують розщеплення геміцелюлоз з утворенням різних моноцукридів і уронових кислот. Ксилана-за (КФ 3.2.1.8; ксилан- 4 - ксиланогідролаза) розщеплює ксилан до ксилози.
Протеїназа (3.4.4; пептидилпептидгідролаза, пептидгідролаза, або протеаза, протеолітичні ферменти) каталізує гідролітичне розщеплення білків І поліпептидів, тобто розрив зв'язків 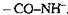 , До цієї групи ферментів належать пепсин (3.4.4.1),
, До цієї групи ферментів належать пепсин (3.4.4.1),
трипсин (3.4.4.4), папаїн (3.4.4.10). Кінцевий продукт гідролізу-амінокислоти.
Пектинази. Ця група ферментів каталізує процеси розщеплення складних пектинових речовин. Найбільш вивчені два види пектолітичних ферментів; пекти-нестераза І полігалактуроназа.
Пектинестераза (КФ 3.1.1.11; пектин - пектилгідролаза) гідролізує метоксиль-ні групи 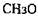 молекули розчинного пектину. У результаті розщеплення складное-
молекули розчинного пектину. У результаті розщеплення складное-
фірних зв'язків утворюється полігалактуронова кислота і метиловий спирт. Діє також на нативний пектин,
Полігалактуроназа (КФ 3.2.1.15; полі- 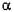 -1,4 -галактуронід - гліканогідрола-за) каталізує гідроліз -
-1,4 -галактуронід - гліканогідрола-за) каталізує гідроліз - 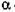 -1,4 -Д -галактуронідні звязки в пектинах та інших поліга-лактуронидах з утворенням вільних
-1,4 -Д -галактуронідні звязки в пектинах та інших поліга-лактуронидах з утворенням вільних  - галактуронових кислот.
- галактуронових кислот.
У склад пектолітичного комплексу входять й інші ферменти, детально не вивчені.
Інвертаза (КФ 3.2.1.26; 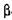 -Д-глюкуронид-глюкуроногідролаза;
-Д-глюкуронид-глюкуроногідролаза; 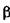 -фруктофура-нозидиза; сахараза) каталізує гідроліз цукрози до глюкози і фруктози.
-фруктофура-нозидиза; сахараза) каталізує гідроліз цукрози до глюкози і фруктози.
Дезамідази (3.5) утворюють групу гідролаз, які каталізують гідроліз лінійних або циклічних амідів (амідогідролази або амідази) і деяких інших ферментів, які роз-

щеплюють звязки 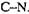 Із амідаз найбільше розповсюдження має аспарагіиаза (КФ
Із амідаз найбільше розповсюдження має аспарагіиаза (КФ
3.5.1.1; 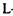 -глютамін-амідогідролаза). У результаті гідролізу цими ферментами лінійних амідів виділяється аміак і відповідні амінокислоти. Уреаза каталізує розпад сечовини (карбаміду) на аміак і вугільну кислоту. До лінійних амідіназ (3.5.3) відноситься аргіназа (
-глютамін-амідогідролаза). У результаті гідролізу цими ферментами лінійних амідів виділяється аміак і відповідні амінокислоти. Уреаза каталізує розпад сечовини (карбаміду) на аміак і вугільну кислоту. До лінійних амідіназ (3.5.3) відноситься аргіназа (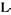 -аргінін-урогідролаза), що каталізує гідролітичне розщеплення аргініну до орнітину і сечовини. До циклічних амідиназ (3.5.4) відносяться цитозин - дезаміназа, аденін-дезаміназа, аденозин-дезаміназа, АМФ-дезаміназа. Вони каталізують гідроліз (дезамінування) піридинових або пуринових основ, також нуклеотидів.
-аргінін-урогідролаза), що каталізує гідролітичне розщеплення аргініну до орнітину і сечовини. До циклічних амідиназ (3.5.4) відносяться цитозин - дезаміназа, аденін-дезаміназа, аденозин-дезаміназа, АМФ-дезаміназа. Вони каталізують гідроліз (дезамінування) піридинових або пуринових основ, також нуклеотидів.
Пірофосфатази (3.6) каталізують розщеплення ангідридного зв'язку, наприклад зв'язки фосфорної кислоти. До них належать неорганічна пірофосфатаза (3.6.1.1), аденозинтрифосфатаза або АТФ-аза (3.6.1.3), яка звільнює із молекули АТФ кінцевий залишок фосфорної кислоти з утворенням АДФ.
Ліази каталізують негідролітичне (безпосереднє) розщеплення субстратів на декілька компонентів. При зворотній реакції з окремих компонентів утворюється речовина. Ліази поділяють на п'ять підкласів. Карбоксиліази (карбоксилази і дика-рбоксілази) каталізують відщеплення або фіксацію 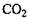 із молекул амінокислот і оксикислот. Піруватдекарбоксилаза або карбоксилаза (КФ 4.1.1.1; карбоксиліаза - 2 - оксокислот) каталізує розщеплення піровиноградної кислоти на ацетальдегід і
із молекул амінокислот і оксикислот. Піруватдекарбоксилаза або карбоксилаза (КФ 4.1.1.1; карбоксиліаза - 2 - оксокислот) каталізує розщеплення піровиноградної кислоти на ацетальдегід і 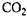 , що є важливою реакцією під час спиртового бродіння. Альдолаза (КФ 4.1.2.7; кетозо - 1 - фосфат – альдегід - ліаза) каталізує розщеплення кетозо - 1 - фосфата на діоксиацетонфосфат і відповідний альдегід. Значна кількість Із цих ферментів має важливе значення в реакціях циклу Кребса.
, що є важливою реакцією під час спиртового бродіння. Альдолаза (КФ 4.1.2.7; кетозо - 1 - фосфат – альдегід - ліаза) каталізує розщеплення кетозо - 1 - фосфата на діоксиацетонфосфат і відповідний альдегід. Значна кількість Із цих ферментів має важливе значення в реакціях циклу Кребса.
Ізомерази
Ферменти цієї групи змінюють положення атома або групи атомів у межах однієї молекули або змінюють просторову будову молекул. До ізомераз належать також ферменти, які здійснюють внутрішньомолекулярні процеси різних типів: оки-сно-відновлювальні процеси (шифр 5.3), ті, що супроводжуються перебудовою молекули субстрату, внутрішньомолекулярним транспортом ацильних, фосфориль-них та інших груп (шифр 5.4).
Ізомерази (5) каталізують ізомерацію органічних сполук, підтримують рівновагу в організмах між двома ізомерами. Ці ферменти включають чотири підкласи.
Лігази (6) або синтази каталізують синтез нових речовин з утворенням зв'язку атома вуглецю з іншими атомами - киснем, азотом, сіркою або вуглецем і одночасним розривом макроергічного зв'язку АТФ або іншого нуклеозидфосфату.
Фосфорні складні ефіри в живих системах підлягають ізомерації, яка каталізується специфічними ферментами ізомеразами. Із гексоз утворюються фосфорні складні ефіри глюкози або фруктози - глюкозо - 6 - фосфат і фруктозо - 6 - фосфат. У результаті каталітичної дії глюкозофосфатізомерази (фосфоглюкомутази) встановлюється рівновага між глюкозо - 6 - фосфатом і глюкозо - 1 - фосфатом.
АКТИВНІСТЬ ФЕРМЕНТІВ
Наявність ферментів солоду або ферментних препаратів мікробного походження визначають з кількості утворених продуктів реакції або зменшення вихідного субстрату. Активність ферментів умовно визначають за початковою швидкістю ферментативної реакції. В оцукрюючих матеріалах визначають амілолітичну, оцукрюючу, глюкоамілазну, протеолітичну й інвертазну активність і виражають їх в умовних одиницях.
Амілолітичну активність (здатність) (A3), яка характеризує дію а-амІлази в ферментних препаратах і 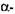 та
та 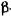 -амілази в солоді, визначають з швидкості ферментативної реакції гідролізу крохмалю, яку встановлюють з кількості крохмалю, що про-гідролізована в процесі цієї реакції. За одиницю амілолітичної активності приймають таку кількість ферменту, яка в строго визначених умовах (температура 30° С, рН 4,7-4,9 і час дії 10 хвилин) каталізує гідроліз до незабарвлених декстринів 1 г розчинного крохмалю.
-амілази в солоді, визначають з швидкості ферментативної реакції гідролізу крохмалю, яку встановлюють з кількості крохмалю, що про-гідролізована в процесі цієї реакції. За одиницю амілолітичної активності приймають таку кількість ферменту, яка в строго визначених умовах (температура 30° С, рН 4,7-4,9 і час дії 10 хвилин) каталізує гідроліз до незабарвлених декстринів 1 г розчинного крохмалю.
Оцукрююча активність (ОА) характеризує здатність усіх амілолітичних ферментів каталізувати гідроліз крохмалю до редукуючих речовин. Активність оцукрюючих матеріалів характеризують числом одиниць оцукрюючих ферментів, що містяться в 1 г солоду, в 1 г ферментного препарату, або в 1 мл глибинної культури.
За одиницю оцукрюючої активності приймають таку кількість ферментів, яка в строго визначених умовах (температура 30° С, рН 4,7-4,9, термін дії 60 хв) каталізує гідроліз 1 г крохмалю, який не перевищує 30 % введеного в ферментативну реакцію.
Глюкоамілазна активність (ГЛА) характеризується кількістю одиниць активності в 1 г сухого ферментного препарату або в 100 мл глибинної культури. За одиницю глюкоамІлазної активності приймають таку кількість ферменту, яка при температурі 30°С і рН 4,7 протягом 1 хв звільнює 1 мкмоль глюкози.
Протеолітична активність (ПА) - здатність протеаз гідролІзувати білок. За одиницю ПА приймають таку кількість ферменту, яка каталізує гідроліз 1 г казеїну в прийнятих стандартних умовах (температура 30° С, рН 7,0, термін дії 30 хв), що складає 50 % від уведеного в ферментативну реакцію.
Інвертазна активність (ІА) - здатність ферменту 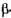 -фруктофуранозидази каталізувати гідроліз цукрози. За одиницю активності прийнято таку кількість ферменту, яка за 1 хв гідролізує 1,25 г цукрози при рН 4,6 і температурі 30° С, що складає не більше 50 % субстрату. Активність препарату виражають в одиницях редукуючих речовин на 1 г препарату або 1 мл розчину ферменту.
-фруктофуранозидази каталізувати гідроліз цукрози. За одиницю активності прийнято таку кількість ферменту, яка за 1 хв гідролізує 1,25 г цукрози при рН 4,6 і температурі 30° С, що складає не більше 50 % субстрату. Активність препарату виражають в одиницях редукуючих речовин на 1 г препарату або 1 мл розчину ферменту.
ВИРОБНИЦТВО СОЛОДУ
Солод - це зерно хлібних злаків, пророщене для утворення в ньому гідролітичних ферментів, в основному амілолітичних і протеолітичних. На вітчизняних спиртових заводах для оцукрювання розвареної маси сировини використовують сирий, свіжопророщений солод. Тому його постійно пророщують під час роботи спиртового заводу.

У деяких країнах (США, Німеччина та ін.) використовують сухий ячмінний солод.
Основні вимоги до солоду в спиртовому виробництві: здатність швидко і повністю оцукрювати крохмаль сировини та частково білкові речовини до амінокислот. Останні використовуються дріжджами як джерело азоту і частково вуглецю. Тому при наявності амінокислот на утворення біомаси дріжджів менше витрачається цукрів, які перетворюються під час зброджування сусла в спирт.
Для нормального ведення технології спирту з солодом потрібно внести такі ферменти: 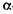 -амілазу,
-амілазу, 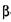 -амілазу, декстриназу і протеолітичні ферменти. Солод із зерна різних злаків містить неоднакову кількість цих ферментів. У зв'язку з цим для вирощування солоду використовують культури зерна ячменю, проса і вівса. Вимоги до зерна для приготування солоду наведені в таблиці 4.3.
-амілазу, декстриназу і протеолітичні ферменти. Солод із зерна різних злаків містить неоднакову кількість цих ферментів. У зв'язку з цим для вирощування солоду використовують культури зерна ячменю, проса і вівса. Вимоги до зерна для приготування солоду наведені в таблиці 4.3.
Табл. 4.3 Характеристика зерна на солод
| Назва показника | Ячмінь ДСТУ 3769-98 | Просо ГОСТ 22983-88 | Овес ГОСТ 28673-90 | Жито ГОСТ 16990-88 |
| Вологість, %, не більше | 15,5 | 15,0 | 16,0 | 15,5 |
| Натура, г/дм3, не менше | не нормується | |||
| Засміченість, %, не більше | 2,0 | 3,0 | 2,0 | 2,0 |
| Зернові домішки, %, не більше | 3,0 | 4,0 | 3,0 | не нормується |
| Здатність до проростання на 5 добу, %, не менше | ||||
| Зараженість шкідниками | не допускається, крім зараженості кліщем, не вище 1 ступеня |
Дуже важливим показником якості зерна на солод є його схожість, яку виражають кількістю зерна в процентах, що проросло на 5-ту добу. Крохмаль непророслих зерен погано оцукрюється в технологічному процесі і складає втрати вуглеводів з дозрілою бражкою. Низьку схожість має свіжезібране зерно.
Ячмінний солод має високу 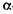 - і
- і 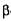 -амілолітичну активність і низьку дектрино-літичну активність.
-амілолітичну активність і низьку дектрино-літичну активність.
Просяний солод має слабу 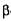 -амілолітичну, середню
-амілолітичну, середню 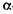 -амілолітичну і високу декстринолітичну ативність.
-амілолітичну і високу декстринолітичну ативність.
Вівсяний солод має невисоку амілолітичну, але значну протеолітичну активність. У ньому накопичується значна кількість амінокислот, у зв'язку з чим цей солод бажано використовувати в основному для приготування сусла для дріжджів.
Технологія солоду спиртового виробництва включає такі стадії: замочування зерна, пророщування зерна і приготування солодового молока.

----------------------------------------- Одержання солоду та мікробних ферментних препаратів---
В.О. Маринченком, В.М. Ісаєнко, Р.І. Чіпчаром розроблена матеріале- і енергозберігаюча технологія солоду, яка дозволяє майже в 2 рази скоротити термін вирощування і витрати солоду. Проте традиційні способи ще використовують на багатьох спиртових заводах. Тому спочатку розглянемо їх.
ЗАМОЧУВАННЯ ЗЕРНА
Мета замочування - збільшити вологість зерна до 40-48%, відділити його від пилу, видалити легкі зернові і незернові домішки і дезинфікувати зерно. Для підтримання життєдіяльності зерна і прискорення процесів його миття зерно з водою аерують. Переважно використовують повітряно-водяне замочування, при якому зерно почергово знаходиться то під шаром води, то без нього.
Під час замочування проходять фізико-хімічні та біохімічні процеси, що викликають значні зміни в зерні.






