Этот метод основан на составлении ионных уравнений для процессов окисления восстановителя и для реакций восстановления окислителя с последующим суммированием обеих уравнений в общее ионное уравнение.
Степень окисления при этом определять не нужно, так как рассматривается участие в реакции не отдельного атома, а реального иона.
Чтобы составить уравнение окислительно-восстановительной реакции методом полуреакций, необходимо: 1)составить ионно-молекулярную схему реакции, помня, что сильные электролиты записываются в виде ионов, а слабые электролиты, газы, осадки - в виде молекул. В ионную схему включаются только те частицы (ионы, атомы, молекулы), которые подвергаются изменению, т.е. окислитель, восстановитель, а также ионы Н+ и ОН-, характеризующие среду, или молекула воды; 2)составить электронно-ионные уравнения отдельно для процессов восстановления и окисления, руководствуясь следующими правилами:
· Если продукт реакции содержит меньше кислорода, чем исходное вещество, то в кислой среде освобождающийся кислород связывается с ионами Н+, в результате чего образуется столько молекул воды, сколько не хватает атомов кислорода. В нейтральной и щелочной средах освобождающийся кислород взаимодействует с водой, образуя удвоенное число гидроксильных групп.
· Если исходное вещество содержит меньше атомов кислорода, чем продукт реакции, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, а в щелочных – за счет удвоенных гидроксильных групп.
На основании закона сохранения массы и энергии должно быть равенство числа частиц (ионов, атомов, молекул) в левой и правой частях уравнения. Суммарное число и знак электрических зарядов слева и справа от знака равенства должны быть одинаковы.
Пример.
Рассмотрим реакцию восстановления перманганата калия по схеме
 |
KMnO4 +Na2SO4 + H2SO4 MnSO4 + Na2SO4 + K2SO4 + H2O:
1) в кислой среде. Запишем:
 |
K++(MnO4)-+2Na++(SO3)2-+2H++(SO4)2-
Mn2++(SO4)2-+2Na++(SO4)2-+2K++(SO4)2-+H2O
Составляем ионно-молекулярную схему реакции, показывающую ионы, претерпевшие изменения и ионы среды.
 |
(MnO4)- + (SO3)2- + H+ Mn2+ + (SO4)2- + H2O
Составляем схемы превращений ионов.
 |  |
(SO3)2- (SO4)2- (MnO4)- (Mn)2+
Недостаток кислорода восполним молекулой воды, т. к. среда кислая, и уравняем число атомов водорода:
(SO3)2- + H2O = (SO4)2- +2H+
(MnO4)- + 8H+ = Mn2+ + 4H2O
Сосчитаем заряды в левой и правой частях схемы и найдем число отданных и принятых электронов.

 5 (SO3)2- + H2O - 2e- = (SO4)2- + 2 H+ процесс окисления
5 (SO3)2- + H2O - 2e- = (SO4)2- + 2 H+ процесс окисления
 |  |
10 -2 0
восстановитель
2 (MnO4)- + 8H+ + 5e- = Mn2+ + 4H2O процесс восстановления
 |  |
+7 +2
окислитель
Уравниваем число отданных и принятых электронов, найдя множители 2 и 5. Умножаем каждое уравнение на соответствующий множитель и почленно складываем их (кроме электронов), получаем:
5(SO3)2- + 5H2O +2(MnO)- +16H+ = 5(SO4)2- +10H+ + 2Mn2+ +8H2O
Приводим подобные члены:
5(SO3)2- + 2(MnO4)- + 6H+ = 5(SO4)2- + 2Mn2+ + 3H2O.
От полученного ионно-молекулярного уравнения переходим к полному молекулярному уравнению, приписывая противоионы и не нарушая общего равенства уравнения:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + 3H2O
2)в нейтральной среде:
 |
KMnO4 + Na2SO3 + H2O MnO2 + KOH + Na2SO3
 |
K+ +(MnO4)- +2Na+ +(SO3)2 +H2O MnO2 +K+ +OH- +2Na+ +(SO3)2-
 |
(MnO4)- +(SO3)2 +H2O MnO2 + OH +(SO3)2-



 2 (MnO4)- + 2H2O +3e = (MnO2)- + 4OH- процесс восстановления
2 (MnO4)- + 2H2O +3e = (MnO2)- + 4OH- процесс восстановления
6 -1 -4
3 (SO3)2- + H2O – 2e = (SO4)2- + 2H+ процесс окисления
 |  |
-2 0
2MnO4- + 4H2O + 3SO32- + 3H2O = 2MnO2 + 8OH- + 3SO42- + 6H+
2MnO4- + 7H2O + 3SO32- = 2MnO2 + 6H2O + 3SO42- + 2OH-
2MnO4- + H2O + 3SO32- = 2MnO2 + 3SO42- + 2OH-
В молекулярном виде:
2KMnO4 + H2O + 3Na2SO3 = 2MnO2 + 3Na2SO4 + 2KOH.
3)в щелочной среде:

KMnO4 + Na2SO3 + KOH K2MnO4 + Na2SO4 + H2O
 |
K++(MnO4)-+2Na++(SO3)2- + K+ + OH- 2K+ +(MnO4)2- +2Na+ + +(SO3)2-+H2O
 |
(MnO4)-+(SO3)2-+OH- (MnO4)2- +(SO3)2-+H2O



 2 (MnO4)- + 1e = (MnO4)2- процесс восстановления
2 (MnO4)- + 1e = (MnO4)2- процесс восстановления
2 -1 -2

 1 (SО3)2- + 2OH- – 2e = (SO4)2- + H2O процесс окисления
1 (SО3)2- + 2OH- – 2e = (SO4)2- + H2O процесс окисления
-4 -2
2(MnO4)- + (SO3)2- + 2OH- = 2(MnO4)2- + (SO3)2- + H2O
В молекулярном виде:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
 |
Al + HNO3 Al (NO3)3 + N2O + H2O
 |
Cu + H2SO4конц. CuSO4 + H2O + SO2
2. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
 |  |  |
а)Cl0 Cl+7 б)Cr+3 Cr+6 в)S+6 S-2
На основании электронно-ионного баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
 |
H2SO4конц + Zn ZnSO4 + H2O + H2S
Укажите окислитель и восстановитель.
3. Реакции выражаются схемами:
 |
P + H JO3 + H2O H3PO + HJ
 |
H2S + Cl2 + H2O H2SO4 + HCl
Расставьте коэффициенты в уравнениях реакций на основании электронно-ионного баланса. Для каждой реакции укажите, какое вещество окисляется, какое - восстановляется, что является окислителем, а что – восстановителем.
4. В каких превращениях происходит восстановление исходных ионов:
 |  |
а) MnO4- Mn+2 г) VO3 V3+
 |  |
б) Cl- ClO4- д) CrO2- CrO42-
 |  |
в) Cr2O72- Cr3+ е) NH3 NO
На основании электронно-ионных уравнений расставьте коэффициенты в уравнениях реакции:
а) FeSO4 + KClO3 + H2SO4 б) Fe2 (SO4)3 + KCl + H2O
5. Исходя из степени окисления хлора в соединениях HCl, HClO3 , HClO4, определите, какое из них является только окислителем, какое – только восстановителем, какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
 |
K2MnO4 + H2O KMnO4 + MnO2 + KOH
6. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронно-ионного баланса расставьте коэффициенты в уравнениях, идущих по схемам:
 |
KI + NaNO2 + H2SO4 NO + I2 + H2O + K2SO4 + Na2SO4
 |
KNO2 + KMnO4 + H2SO4 MnSO4 + KNO3 + K2SO4 + H2O
7. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
 |
FeSO4 + KMnO4 +H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
 |
KCrO2 + Br2 + KOH K2CrO4 + KBr + H2O
8. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
 |
K2Cr2O7 + H2S + H2SO4 Cr2(SO4)3 + S + K2SO4 + H2O
 |
K2MnO4 + Cl2 KMnO4 + KCl
9. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
 |
J2 + NaOH NaJO + NaJ
 |
Cu + H2SO4 CuSO4 + SO2 + H2O
10. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
 |
HNO3 + Zn N2O + Zn(NO3)2 + H2O
 |
Cr2O3 + KClO3 + KOH K2CrO4 + KCl + H2O
11. Найдите окислитель и восстановитель, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
 |
J2 + Cl2 + H2O HJO3 + HCl
 |
HNO3 + Ca NH4NO3 + Ca(NO3)2 + H2O
12. Составьте электронно-ионные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
 |  |  |
а) Cu0 Cu+2 б) N02 N+2 в) S+6 S+2
На основании электронно-ионного баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
 |
SO2 + NaJO3 + H2O NaJ + H2SO4
13. Oпределите степень окисления элементов в следующих соединениях: сульфат железа (III), нитрат алюминия, карбонат натрия. Расставьте коэффициенты методом полуреакций в уравнении реакции, идущей по схеме:
 |
PbS + HNO3 S + Pb (NO3)2 + NO + H2O
14. Как меняется число электронов в атомах при следующих степенях окисления:
 |  |  |
а) S+4 S-2 б) S-2 S+6 в) Mn+4 Mn+7
В каких случаях идет окисление, а в каких восстановление? На основании электронно-ионных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
 |
H3AsO3 + KMnO4 + H2SO4 H3AsO4 + MnSO4 + K2SO4 + H2O
15. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронно-ионных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам:
 |
Na2SO3 + KClO3 KCl + Na2SO4
 |
H2SO3 + H2S H2O + S
16. Исходя из степени окисления фосфора, хрома, серы в соединениях PH3, K2Cr2O7, H2SO3, определите, какое из них окислитель, какое восстановитель, а какое может проявлять как окислительные, так и восстановительные свойства. Почему? Расставьте коэффициенты в уравнениях реакции, идущей по схеме:
 |
Na2Cr2O7 + NaNO2 +H2SO4 Cr2(SO4)3 +NaNO3 + Na2SO3 + H2O
17. Завершите составление уравнений следующих реакций и расставьте коэффициенты:
 |
NaNO3 + NaJ + H2SO4 NO + J2 +…
 |
Cr2(SO4)3 + FeSO4 + H2SO4 Cr2(SO4)3 + Fe2(SO4)3 + …
18. Завершите составление уравнений следующих реакций и расставьте коэффициенты:
 |
Zn + HNO3 N2 + Zn(NO3)2 + …
 |
Cr2(SO4)3 +NaOH + Cl2 NaCl + Na2CrO4 + …
19. Составьте уравнение следующих окислительно-восстановительных реакций, если известны конечные степени окисления элементов:
 |
C + H NО3конц. (C+4, N+2)
 |
PH3 + KMnO4 + H2SO4 (Mn+2, P+5)
20. Могут ли происходить окислительно-восстановительные реакции между веществами:
а) NH3 и KMnO4 б) HNO2 и HJ в) HCl и H2Se
Почему? На основании электронного баланса расставьте коэффициенты в уравнении, идущей по схеме:
 |
NaCrO2 + PbO2 + NaOH Na2CrO4 + Na2 PbO2 + H2O
21. Могут ли происходить окислительно-восстановительные реакции между веществами?
а) PH3 и HBr б) K2Cr2O7 и H3PO3 в) HNO3 и H2S
Почему? На основании электронного баланса расставьте коэффициенты в уравнении, идущем по схеме:
 |
Au + HNO3 + HCl AuCl3 + NO + H2O
22. Серебряные предметы чернеют под действием сероводорода, содержащегося во влажном воздухе по схеме:
 |
Ag + H2S + O2 Ag2S + H2O
Расставьте коэффициенты на основании электронно-ионного баланса, укажите окислитель и восстановитель.
23. Какие функции могут выполнять в реакциях окисления-восстановления атомы металлов?
Исходя из степени окисления азота в соединениях NH3, HNO2, HNO3, объясните, какое из них может быть только окислителем, какое только восстановителем, а какое может проявлять как те так и другие свойства?
Составьте уравнение реакции, идущей по схеме:
 |
KMnO4 + H3PO3 + H2SO4 MnSO4 + H3PO4 + K2SO4 + H2O
24. В чем состоит сущность процессов окисления и восстановления? Как называются вещества, отдающие электроны, принимающие электроны? Исходя из степени окисления хлора в соединениях HClO4, KClO3, HClO,HCl, объясните, какое из них проявляет только окислительные, а какое только восстановительные свойства. Составьте уравнение реакции, идущей по схеме:
 |
Cr2O3 + KNO3 + KOH K2CrO4 + KNO2 + H2O
25. Что называется степенью окисления? Чему равна степень окисления простого вещества?
Исходя из степени окисления серы в соединениях H2SO4, K2SO3, H2S, объясните, какие из них могут быть только окислителями, а какие только восстановителями, а также какие могут проявлять и окислительные, и восстановительные свойства?
Составьте уравнение реакции, идущей по схеме:
 |
P + HNO3 + H2O H3PO4 + NO
26. Как изменяются восстановительные свойства элементов в периодах периодической системы Д.И. Менделеева? Исходя из степени окисления фосфора в соединениях PH3, H3PO4, H3 PO3, объясните, какие из них могут быть только окислителями, а какие только восстановителями, а также какие могут проявлять и окислительные, и восстановительные свойства? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
 |
PbS + HNO3 S + Pb(NO3)2 + NO + H2O
27. Какие химические реакции относятся к окислительно-восстановительным? Какими признаками это определяется? Чем объясняется их «двойное» название?
Составьте электронно-ионные уравнения и укажите, какой процесс (окисление или восстановление) происходит при следующих превращениях:
 |  |  |
а) Mn2+ Mn+6 б) Cl+5 Cl- в) N-3 N+5
На основании электронного баланса расставьте коэффициенты в уравнении, идущем по схеме:
 |
NaCrO2 + PbO2 + NaOH Na2CrO4 + Na2PbO2 + H2O
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
В реакциях окисления-восстановления электроны хаотично переходят от восстановителя к окислителю. Если эти процессы пространственно разделить так, чтобы переход электронов совершался направленно по металлическому проводнику, то получим электрический ток. Окислительно-восстановительные реакции, протекающие с образованием электрического тока или под действием электрического тока, называются электрохимическими процессами.
Рассмотрение электрохимических процессов начнем с электродных потенциалов.
При погружении металла в раствор его соли происходит окисление металла и его гидратированные ионы переходят в раствор, заряжая последний положительно. Электроны, остающиеся в металле, заряжают его отрицательно.
Разность потенциалов, возникающая между поверхностью металла и раствором, называется электродным потенциалом, а система металл-раствор называется электродом. Так как процесс ионизации металла обратимый процесс, то через некоторое время возникает равновесие: сколько ионов переходит в раствор за единицу времени, столько же их на металле теряют заряд.

 Ме + mH2O Me (H2O)mn+ + ne
Ме + mH2O Me (H2O)mn+ + ne
В условиях равновесия образующийся между металлом и раствором потенциал наывается равновесным потенциалом и обозначается е.
Определить абсолютное значение потенциалов невозможно. Однако можно определить значение потенциала относительно другого электрода. В качестве такого электрода сравнения используется стандартный водородный электрод, потенциал которого принимается равным нулю. Данный электрод состоит из платиновой пластинки, погруженной в раствор серной кислоты, где концентрация СН+ равна 1моль/л. Через раствор пропускается водород (давление 1 атм.), который адсорбируется пластиной. Часть водорода становится атомами и ионизируется:
Н2 = 2Н+

 Н Н+ + е-
Н Н+ + е-
Образуется водородный электрод, который обозначается
Pt (H2)/2H+
При определении стандартного потенциала металла, его электрод соединяется с водородным электродом и измеряется значение разности потенциалов.
Электродный потенциал растворения металла, погружённого в раствор его соли, измеренный в стандартных условиях по отношению к потенциалу стандартного водородного электрода, называется стандартным потенциалом.
Стандартные условия: С = 1 моль/л, t = 23 – 25oC, P = 1 атм.
Расположив металлы в ряд по мере увеличения их стандартных электродных потенциалов (e0), получим ряд, называемый рядом стандартных электродных потенциалов металлов. Положение металла в этом ряду характеризует его химическую активность в растворе.
В начале ряда помещены активные металлы с малым значением потенциала. Малоактивные металлы располагаются после водорода и имеют положительные значения потенциалов. Между активными металлами и мало активными располагаются металлы средней активности (условно от марганца e0Mn2+/Mn = -1.18В до H.
Стандартные потенциалы металлических электродов приводятся в таблице (t=25оС).
Таблица 1.
| Электрод | Е0,В | Электрод | Е0,В |
| Li / Li+ Rb / Rb+ K / K+ Cs / Cs+ Ba / Ba2+ Sr / Sr2+ Ca / Ca2+ Na / Na+ La / La3+ Mg / Mg2+ Sc / Sc3+ Be / Be2+ U / U3+ Al / Al3+ Ti / Ti2+ Ti / Ti4+ Mn / Mn2+ V / V 2+ Cr / Cr2+ | -3.05 -2.93 -2.92 -2.92 -2.91 -2.89 -2.87 -2.71 -2.52 -2.36 -2.08 -1.85 -1.80 -1.66 -1.63 -1.23 -1.18 -1.17 -0.91 | Zn / Zn2+ Cr / Cr3+ Fe / Fe2+ Cd / Cd2+ Tl / Tl+ Co / Co2+ Ni / Ni2+ Sn / Sn2+ Pb / Pb2+ Fe / Fe3+ H2 / 2H+ Bi / Bi3+ Cu / Cu2+ Cu / Cu+ Ag / Ag+ Hg / Hg2+ Pt / Pt2+ Au / Au3+ Au / Au+ | -0.76 -0.74 -0.44 -0.40 -0.34 -0.28 -0.25 -0.14 -0.13 -0.04 -0.00 +0.21 +0.34 +0.52 +0.80 +0.85 +1.19 +1.50 +1.70 |
Из этой таблицы следует:
1) чем меньше е0, тем металл химически активнее, тем он легче окисляется и труднее восстанавливается из своих ионов.
2) металлы, имеющие е0< 0 В вытесняют водород из разбавленных кислот, анионы которых не проявляют окислительных свойств (H2SO4,HCL и др.).
3) металлы вытесняют (восстанавливают) все другие металлы, имеющие более высокое значение е0 из растворов их солей.
4) чем больше разность потенциалов у двух металлов, тем больше величина ЭДС.
Пример.
Будет ли взаимодействовать алюминий с раствором сульфата никеля?
Решение: по таблице находим
e0Al+3/Al = -1.66В
е0Ni2+/Ni = - 0.25В
Потенциал Al меньше, следовательно, алюминий более сильный восстановитель, чем никель, от него электроны будут переходить к ионам никеля:
2Al + 3NiSO4 = Al2(SO4)3 + 3Ni
Фактически протекает реакция:
2Al0 + 3Ni2+ = 2Al+3 + 3Ni
Пример.
Цинк может вытеснять водород из растворов кислот, так как e0Zn2+/Zn равен -0,76В и меньше, чем потенциал водорода.
Zn + 2HCl = ZnCl2 + H2
Zn – 2e- = Zn2+
2H+ + 2e- = H2
Медь не может вытеснять водород из растворов кислот, так как имеет потенциал +0,34, больше нуля.
Электродный потенциал зависит от природы металла температуры, концентрации ионов металла в растворе. Эта зависимость выражается уравнением Нернста:

 , где
, где
е0 –стандартный эдектродный потенциал;
n – число e-,принимающих участие в процессе;
СMen+ - концентрация ионов металла в растворе.
Из формулы следует, что чем больше разбавленный раствор, тем более отрицательно значение потенциала металла.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
28. В два сосуда с голубым раствором CuSO4 поместили в первый цинковую пластинку, во второй – серебряную пластинку. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
29. Увеличивается, уменьшается или остается без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a)AgNO3; b)ZnSO4; c) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
30. Увеличивается, уменьшается или остается без изменения масса цинковой пластинки при взаимодействии с растворами: a) CuSO4; b)MgSO4; c)Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
31. Рассчитайте электродные потенциалы магния в растворе его соли при концентрациях иона Mg2+ 0,1, 0,01, 0,001 моль/л
32. Вычислите потенциал водородного электрода погруженного в чистую воду; в раствор с PH=10,7
33. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0.015 В меньше его стандартного электродного потенциала?
34. Стандартный электродный потенциал никеля больше, чем кобальта. Измениться ли это соотношение, если изменить потенциал никеля в растворе его ионов с концентрацией 0.001 моль/л, а потенциал кобальта – в растворе с концентрацией 0.1 моль/л?
35. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен –2,41 В. Вычислить концентрацию ионов магния (в моль/л).
36. Потенциал серебряного электрода в растворе нитрата серебра составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов серебра (в моль/л)?
37. При какой концентрации ионов Cu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода.
38. В каком случае происходит реакция при внесении цинковой, железной и свинцовой пластинок в раствор сульфата олова (II). Напишите молекулярные и электронные уравнения реакций.
39. В какой пробирке происходит реакция при внесении цинковых пластинок в пробирки с растворами сульфата меди и сульфата магния. Напишите молекулярные и электронные уравнения реакций.
40. В какой пробирке происходит реакция при внесении цинковых пластинок в разбавленные растворы серной кислоты гидроксида калия сульфата магния? Напишите молекулярные и электронные уравнения реакций.
41. Увеличится, уменьшится, или останется без изменений масса железной пластинки при внесении ее в раствор сульфата меди (II), сульфата калия. Почему? Напишите молекулярные и электронные уравнения реакций.
42. Какова масса технического железа, содержащего 18% примесей, требуется для вытеснения из раствора сульфата никеля (II) 7,42 г. никеля.
43. В раствор нитрата серебра опущена медная пластинка массой 28г. По окончании реакции пластинка была вынута из раствора, обмыта, высушена и взвешена. Масса ее оказалась 32,75 г. Какая масса нитрата серебра была в растворе.
44. Потенциал водородного электрода равен –0,145 В. определите рН раствора.
45. С какими из перечисленных ниже веществ будет реагировать железо: а) Хлороводородная кислота б) сульфат цинка в) нитрат серебра. Напишите молекулярные и электронные уравнения реакций.
46. Потенциал водородного электрода в некотором водном растворе равен –118мВ. Вычислить концентрацию ионов водорода в этом растворе.
47. В два сосуда с розовым раствором сульфата кобальта (II) опустили железную и медную проволоки. В каком сосуде цвет раствора постепенно изменяется и почему? Напишите молекулярные и электронные уравнения реакций.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Если разделить пространственно процессы окисления и восстановления, то окислительно-восстановительную реакцию можно использовать для получения электрической энергии.
Устройство в котором, химическая энергия превращается в электрическую, называется гальваническим элементом. Гальванический элемент образуется из двух металлов, погруженными в раствор электролитов. Если соединить эти металлы проводником первого рода (металлический провод), то будет образовываться электрический ток, появляющийся вследствие возникновения окислительно-восстановительного процесса. В гальваническом элементе анодом служит электрод, электродный потенциал которого в данном растворе более электроотрицательный. На аноде происходит окисление. Катодом служит электрод из менее активного металла. На катоде восстановляются положительные ионы металлов, ионы водорода или нейтральные молекулы. В гальваническом элементе анод обозначается знаком «минус», а катод – знаком «плюс». Гальванический элемент показан на рисунке.
Цинковая пластинка опущена в раствор сульфата цинка, медная - в раствор сульфата меди. Пластинки соединены проводом, растворы разделены пористой перегородкой, чтобы не происходило смешение растворов. Электроны по внешней цепи идут от анода к катоду, а по внутренней цепи анионы SO42- перемещаются в растворе от меди к цинку, замыкая электрическую цепь гальванического элемента.
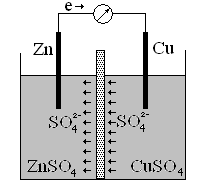
Гальванический элемент записывается в виде электрохимической схемы:
A(-) Zn | ZnSO4 || CuSO4 | Cu (+)K
Так как электродный потенциал цинка меньше электродного потенциала меди то цинк будет анодом, а медь – катодом. Цинковая пластинка окисляется, а на поверхности медной пластинки идёт восстановление меди из раствора.
Процессы, протекающие при работе гальванического элемента, следует записать:
A Zn – 2e = Zn2+
 K Cu2+ + 2e = Cu0
K Cu2+ + 2e = Cu0
Zn + Cu2+ = Zn2+ + Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода:
ЭДС= еK - еA
Для медно-цинкового гальванического элемента в стандартных условиях:
ЭДС = 0,34-(-0,76)=1,1 В
Разность потенциалов образуется не только между разными, но и между одноименными металлами, прогруженными в растворы своих солей с разными концентрациями. Такой гальванический элемент называется концентрационным. Например, никелевый концентрационный гальванический элемент.
(-)Ni | NiSO4 || NiSO4 | Ni (+)
0,01моль 0,1моль
Запишем работу такого концентрационного гальванического элемента.
еNi2+/Ni = е0 + (0,058/n)lg(1*10-2) = -0.25 + (0,058/2)(-2) = -0.308 В
еNi2+/Ni = е0 + (0,058/n)lg(1*10-1) = -0.25 + (0,058/2)(-1) = -0.28 В
ЭДС = -0,28 – (-0,308) = 0,028 В
Процессы на электродах:
А: Ni0 - 2е- = Ni2+
К: Ni2++ 2е- = Ni0
КОНТРОЛЬНЫЕ ЗАДАНИЯ
48. Вычислить ЭДС кадмиево – серебряного гальванического элемента, если концентрация ионов серебра в растворе равна 0,1 моль/л, а ионов кадмия 0,001 моль/л. Напишите уравнения реакций протекающих на электродах.
49. Составьте схемы двух гальванических элементов в одном из которых никель – катод, а в другом анод. Напишите уравнения реакций протекающих при работе этих элементов.
50. Рассчитайте ЭДС гальванического элемента, составленного из железной и свинцовой пластинок, опущенных в 0,1М растворы их солей. Напишите уравнения реакций.
51. Рассчитайте ЭДС концентрационного никелевого гальванического элемента. Концентрация ионов металла в растворах равна 1 моль/л и 0,0001 моль/л. Написать процессы, протекающие на аноде и катоде.
52. Какие процессы происходят у электродов медного коцентрированного гальванического элемента, еслиу одного из электродов концентрация ионов металла равна 1 моль/л, а у другого 0,001 моль/л. в каком направлении движутся электроны во внешней цепи. Чему равна ЭДС?
53. Составьте схему гальванического элемента, состоящего из пластин Zn и Fe погруженных в растворы их солей. Напишите уравнения процессов, протекающих на ионы железа, чтобы ЭДС элемента стала равной нулю при концентрации ионов цинка 0,0001 моль/л.
54. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента, напишите уравнения реакций, протекающих на пластинах.
55. Составьте схему гальванического элемента, состоящего из серебряного электрода, погруженного в 1М раствор нитрата серебра и стандартного водородного электрода. Напишите урaвнения электродных процессов. Чему равна ЭДС элемента?
56. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов
а) Mg | Mg2+ | | Pb2+ | Pb
б) Pb | Pb2+| |Cu2+ | Cu
в) Cu | Cu2+| | Ag2+| Ag
если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев.
57. Составьте схему гальванического элемента в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2= Ni(NO3)2 + Pb.
Напишите электронные уравнения анодного и катодного процессов, вычислите ЭДС этого элемента при стандартных условиях.
58. ЭДС гальванического элемента, образованного медной пластинкой, погруженной в раствор ее соли с концентрацией ионов меди, равной 0,001 моль/л и хромом, погруженным в раствор его соли равна 1,05 В. определите концентрацию ионов хрома в растворе его соли. Составьте схему гальванического элемента и напишите электронные уравнения электродных процессов.
59. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенные в растворы своих солей с концентрацие ионов металлов, равной 1 моль/л. изменится ли ЭДС этого гальванического элемента, если концентрацию каждого из ионов уменьшить до 0,01 моль / л.
60. ЭДС гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1М раствор соли свинца равна 126мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода. Составьте схему гальванического элемента и напишите процессы, протекающие на электродах.
61. Какие процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора.
62. Какие процессы протекают на электродах при зарядке и разрядке кадмиево-никелевого аккумулятора.
63. Какие процессы протекают на электродах при зарядке и разрядке железно-никелевого аккумулятора.
64. Составьте схемы двух гальванических элементов в одном из которых хром был бы анодом, а в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах.
65. Составьте схему гальванического элемента, состоящего из алюминиевого электрода, погруженного в 1М раствор нитрата алюминия и стандартного водородного электрода. Напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента.
66. В каком направлении будут перемещаться электроны во внешней цепи алюминий – цинкового гальванического элемента. Концентрации ионов в растворах равны 0,1 моль/л. Составьте схему гальванического элемента, напишите уравнения процессов, протекающих на электродах, вычислите ЭДС.
67. В серебряно-цинковом элементе, применяемом для питания различной аппаратуры, протекает реакция
Ag2O+Zn=2Ag+ZnO
рассчитать стандартную ЭДС, написать уравнение процесса.
ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Во время электролиза положительно заряженные ионы перемещаются к катоду, который соединяется с отрицательным полюсом внешнего источника постоянного тока, а отрицательно заряженные ионы перемещаются к аноду, который соединяется с положительным полюсом источника постоянного тока. На поверхности катода идет процесс восстановления, на аноде – окисление.
Рассмотрим электролиз расплава хлорида натрия.
При погружении в расплав, состоящий из ионов Na+ и Cl-, двух графитовых электродов, подключенных к источнику тока, в электролите начнется направленное движение ионов, и на электродах будут протекать окислительно-восстановительные процессы.
Схема электролиза расплава натрия:
NaCl = Na+ + Cl-


 катод (-) (+) анод
катод (-) (+) анод
Na + + e- = Na0 2Cl- - 2e- = Cl2
Суммарное уравнение реакции:
 2Na+ + 2Cl- электролиз 2 Na + Cl2
2Na+ + 2Cl- электролиз 2 Na + Cl2
 2NaCl электролиз 2Na + Cl2
2NaCl электролиз 2Na + Cl2
При электролизе водных растворов электролитов полярные молекулы воды притягиваются и к катоду, и к аноду, и также могут участвовать в процессах на электродах.
Процессы на катоде
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов. Чем больше величина электродного потенциала элемента, тем легче его восстановление.
Первыми на катоде восстанавливаются ионы тех металлов, потенциал которых самый положительный. Например, раствор с ионами Ag+ и H+. Первым восстанавливается Ag:
Ag+ + e- = Ag0 e0 = +0,8 B
Водород не восстанавливается, так как его потенциал меньше.
Потенциалы металлов и водорода зависят от их концентрации в электролите. Поэтому по значениям стандартного потенциала судить о восстановлении ионов Н+ не всегда можно. В нейтральном расторе концентрация ионов водорода равна10-7 моль/л. и по формуле Нернста: 
Следовательно водород может выделяться из нейтральных растворов только при потенциале меньше –0,41В, а металлы на катоде будут выделяться лишь те, потенциал которых положительнее потенциала –0,41В.
На практике из водородных растворов выделяется немало металлов (Zn, Fe, Cr и др.), значение электродных потенциалов которых менее –0,41В.
Это объясняется перенапряжением водорода, т.е. на поверхности большинства металлов водород выделяется с затруднениями. Величина перенапряжения водорода зависит от свойств металла, плотности тока и температуры электролита. Перенапряжение – зто разница потенциалов между практическим потенциалом выделением водорода и теоретическим.
Пример.
Потенциал выделения цинка в нейтральном электролите –0.76В, водорода –0.41В. перенапряжение водорода на цинке около –0.72В. Таким образом, водород на цинке будет выделяться лишь при потенциале –0.41+(-0.72)=-1.13В. Если сравнить потенциал разряда цинка (-0.76 В) с потенциалом разряда водорода на цинке (-1.13В), ясно, что будет выделяться цинк. На деле так и есть, при электролизе нейтрального раствора соли цинка выделяется цинк и малое количество водорода.
При обобщенном процессе на катоде, в зависимости от нахождения металла в ряду стандартных электродных потенциалов, выделяются три случая:
1) ионы металлов, электродный потенциал которых менее –1.18В (от Li до Mn). Восстанавливаются ионы водорода:
2 Н+ + 2е- = Н2 РН < 7
2 Н2О + 2е- = Н2 + 2ОН- РН >= 7
2) ионы металлов, электродный потенциал которых от –1.18В до 0.00В (от Mn до Н) В этом случае восстанавливаются как ионы металлов, так и ионы водорода одновременно:
Men+ + ne- = Me0
2H+ + 2e- = H2 PH<7
2H2O + 2e- = H2 + 2OH- PH>=7
3) ионы металлов, электродный потенциал которых больше 0.0В (от H до Au). В этом случае восстанавливаются только ионы металлов
Меn+ + ne- = Me0
Процессы на аноде
Для электролиза используют растворимые (активные) и нерастворимые (инертные) аноды. Во время электролиза растворимые аноды растворяются и ионы металла – анода переходят в раствор. Обычно растворимые аноды изготавливаются из того металла, соль которого подвергается электролизу.
Нерастворимые аноды в окислительно-восстановительных реакциях не участвуют. Обычно это аноды из графита, золота, платины. На их поверхности окисляются анионы с более отрицательными потенциалами. Это ионы не содержащие кислорода, такие как J-, Br- , Cl-, S2- и др. (исключение F-)
Если в растворе имеются ионы Cl-, Br-, то окисляться на инертном аноде будут ионы Br-.
e0Br = +1,07B
e0Cl = +1,36B
2Br- - 2e- = Br2
Кислородсодержащие кислотные остатки на аноде в водных растворах не окисляются. Вместо них окисляются молекулы воды:
2H20 - 4e- = O2 +4H+ (PH<=7)
4OH - 4e- = 2H2O + O2 (PH>7)
Рассмотрим несколько случаев электролиза водных растворов.
Пример.
Схема электролиза водного раствора хлорида меди с инертным анодом CuCl2 = Cu2+ +2Cl-
H2O = H+ = OH-

 катод(-) Cu2+ H+(H2O) Cl-, OH- (H2O) (+)анод
катод(-) Cu2+ H+(H2O) Cl-, OH- (H2O) (+)анод
Cu2+ + 2e- = Cu0 2Cl- -2e- = Cl2
У меди потенциал больше 0, поэтому на катоде восстанавливается металл, на аноде окисляется бескислородный кислотный остаток.
Пример.
Схема электролиза раствора сульфата калия с инертным анодом. K2SO4 = 2K+ + SO42
H2O = H+ + OH-

 катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
2H2O + 2e- = H2 + 2OH- 2H2O – 4e- = O2 + 4H+
K+ + OH- = KOH 2H+ + SO42- = H2SO4
Так как калий в ряду стандартных электродных потенциалов стоит значительно раньше водорода, то на катоде идет восстановление водорода и накопление ионов ОН-
У анода будет идти окисление молекул воды и накопление ионов Н+. Таким образом, в катодном пространстве вторичным продуктом будет щелочь, а в анодном – кислота.
Пример.
Электролиз водного раствора сульфата никеля с активным анодом. Ni SO4 = Ni2+ = SO42-

 H2O H+ + OH-
H2O H+ + OH-

 катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
Ni2+ +2e- = Ni0 Ni – 2e- = Ni2+
e0Ni = -0.25B больше потенциала восстановления ионов водорода из воды(-0,41В), поэтому восстанавливается металл, а на аноде происходит окисление анода-металла, так как потенциал никеля намного меньше потенциала окисления воды (+1,23В).
Законы электролиза
Масса электролита, подверженная химическому превращению, а также массы веществ, выделившихся на электродах по законам Фарадея прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ:
 , где
, где
m -масса электролита, подвергшаяся электролизу или масса веществ, выделившаяся на электродах, г;
J -сила тока, А;
э-молярная масса эквивалентов вещества, г/моль;
F-число Фарадея – 96500 Кл;
t-время электролиза, с;
КОНТРОЛЬНЫЕ ЗАДАНИЯ
68. Составьте уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl2 с инертными электродами.
69. Составьте схемы электролиза водных растворов серной кислоты, хлорида меди, нитрата свинца с платиновыми электродами.
70. Напишите уравнения электродных процессов, протекающих при электролизе водных растворов хлорида бария и хлорида железа (II) с угольными электродами.
71. Составьте схемы электролиза водного раствора хлорида цинка, если а) анод цинковый; б) анод угольный.
72. Какой объем водорода выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор серной кислоты.
73. При электролизе водного раствора SnCl2 на аноде выделилось 4,48 л. хлора (условия нормальные). Какое вещество и в каком количестве выделилось на катоде.
74. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди. Напишите уравнения процессов на электродах.
75. Составьте схему процессов, происходящих на медных электродах при электролизе водного раствора нитрата калия.
76. Неочищенная медь содержит примеси серебра и цинка. Что происходит






