1. За формулою (6) обчислити середнє значення коефіцієнта теплопровідності.
2. Визначити відносну і середню абсолютну похибки вимірювання і записати кінцевий результат  .
.
Контрольні запитання
1. Основні види теплообміну.
2. Теплопровідність як явище переносу енергії та й пояснення.
3. Закон Фур'є.
4. Фізичний зміст коефіцієнта теплопровідності, одиниця його вимірювання в системі СІ.
Лабораторна робота № 7.5
ДОСЛІДЖЕННЯ КРИТИЧНИХ ЯВИЩ В СИСТЕМІ РІДИНА – ПАРА
Мета роботи: провести спостереження за проходженням ефіру через критичний стан, визначити його критичну температуру і розрахувати поправки Ван-дер-Ваальса.
Прилади і матеріали: запаяна скляна ампула з ефіром; сушильна шафа з додатковим електричним підігрівом та освітлювальною лампочкою; термометр; автотрансформатор.

Теоретичні відомості
На відміну від ідеального газу, стан якого описується рівнянням Менделєєва-Клапейрона, молекули реальних газів мають певні розміри (власний об'єм) і потенціальну енергію взаємодії. Тому рівняння Менделєєва-Клапейрона для реальних газів виявляється неточним і тільки в певному наближенні описує їх стан при досить високих температурах та малих тисках. В інших умовах нехтувати розмірами молекул та силами їх взаємодії для реальних газів не можна.
Виходячи з цих міркувань у 1873 році голландський фізик Ван-дер-Ваальс ввів до рівняння Менделєєва-Клапейрона поправки відповідно на розміри молекул і на взаємодію між ними.
Якщо уявити молекули реальних газів у вигляді сферичних утворень та врахувати, що вони не можуть бути щільно упаковані, то можна показати, що кожна з них створює навколо себе недоступний для інших молекул об'єм, рівний чотирьом власним об'ємам однієї молекули. Для одного моля реального газу об'єм, який займають його молекули, можна знайти із співвідношення.
b=4NAV, (1)
де b – поправка Ван-дер-Ваальса на розмір молекул 1 моля реального газу;
na = 6,02×1023 моль-1 – число Авогадро;
V – власний об'єм однієї молекули.
Таким чином, у рівнянні Менделєєва-Клапейрона вільний об'єм газу буде меншим на величину b, тобто Vm-b.
Крім того, завдяки силам взаємного притягання, молекули реального газу додатково стискуються, збільшуючи внутрішній тиск і зменшуючи тиск на стінки посудини на величину р'. Аналіз процесів взаємодії молекул приводить до формули:
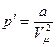 , (2)
, (2)
де р' - додатковий тиск;
а — поправка Ван-дер-Ваальса на взаємодію між молекулами;
Vm – об'єм 1 моля реального газу.
Поправки а і b для різних реальних газів даються в спеціальних таблицях.
Отже, з врахуванням поправок а і b рівняння Ван-дер-Ваальса для 1 моля реального газу має вигляд:
 . (3)
. (3)
Для довільної маси газу m, рівняння Ван-дер-Ваальса записується в вигляді:
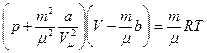 . (4)
. (4)
Для реальних газів характерне так зване явище критичного стану, яке спостерігається при їх ізотермічному стисненні чи розширенні при відповідній критичній температурі. До поняття критичного стану речовини можна підійти на основі аналізу ізотерм Ендрюса, який досліджував залежність молярного об'єму вуглекислого газу від тиску при різних температурах (рис. 7.5.1).
При сталій температурі Т на ділянці АВ газ стискується. В точці В ізотерми газ досягає насичення і проявляється його рідка фаза.
Ділянці ВС відповідають дві фази: рідина і насичена пара. В точці С увесь газ перетворюється в рідину. З підвищенням температури ізопроцесу (Т1>Т2) горизонтальна ділянка ізотерми ВС зменшується (b1c1<bc) і при певній температурі Тк стягується в точку К. При цій температурі одночасно не існує двофазної області «рідина — насичена пара» і поступового переходу рідини в пару (чи навпаки), якому відповідає горизонтальна ділянка ізотерми (ВС, В1С1) при температурах нижче критичної. В точці К пара миттєво переходить у рідину (при стисненні) або рідина — в пару (при розширенні). Такий стан речовини носить назву критичного.
В точці К питомий об'єм (об'єм одиниці маси) рідини дорівнює питомому об'єму насиченої пари. В критичному стані зникає поверхневий натяг рідкої фази і різниця між рідкою і пароподібними фазами (зникає меніск).
З рис. 7.5.1 видно, що криві КВ1В та КС1С відділяють двофазну область «рідина-пара», що знаходиться нижче кривої ВКС, від двох однофазних областей — рідкої (лівіше кривої СКDк) і газоподібної (правіше кривої ВКDк). При критичній температурі речовина в області правіше кривої DкКАк може знаходитись лише в газоподібному стані.
Критичний стан будь-якої речовини однозначно визначається критичними параметрами: критичною температурою, критичним тиском і критичним об'ємом.
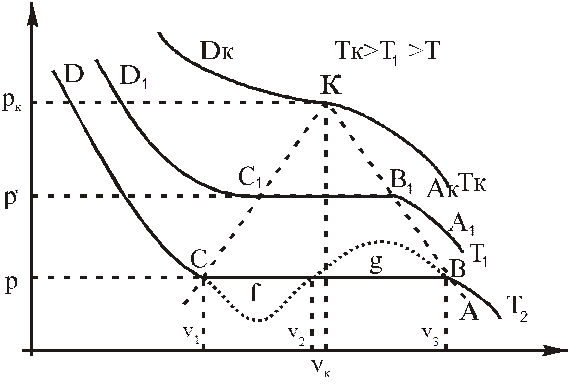
Рис. 7.5.1
Критична температура Тк — це температура, вище якої речовина ніяким чином не може бути переведена з газоподібного стану в рідкий.
Критичний тиск pк – це найбільший тиск насиченої пари даної рідини.
Критичний об'єм vk – це найбільший об'єм, який може займати дана кількість рідини.
Критичні параметри речовини можна виразить через поправки а і b. Для цього рівняння (4) слід привести до нормального стану і записати в порядку зменшення ступенів об'єму:
 . (5)
. (5)
Рівнянню (5) на рис. 7.5.1 відповідає крива ABgfCD (на якій одному значенню р відповідають три значення об'єму V1, V2, V3). Ця крива відрізняється від ізотерми Ендрюса АВСD тільки тим, що замість прямої ділянки ВС є хвилеподібна BgfC. Ділянці Сf відповідає стан перегрітої рідини, а ділянці СD — стан перенасиченої пари, ділянці Bg відповідає cтан, який в природі не спостерігається (із збільшенням об'єму зростає тиск). В цьому і є головна причина наближеного характеру рівняння Ван-дер-Ваальса. Рівняння (5) виразимо через критичні параметри:
 , (6)
, (6)
а врахувавши те, що для критичної точки V1=V2=V3=Vк — ще і так:
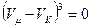 , (7)
, (7)
або, піднісши до куба, матимемо:
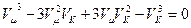 . (8)
. (8)
Рівняння (6) і (8) тотожні, тому прирівнявши коефіцієнти при відповідно однакових vk, одержимо:
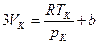 ,
, 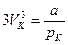 ,
, 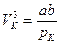 .
.
Розв'язуючи цю систему відносно критичних параметрів, знаходимо:
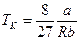 .
. 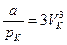 .
. 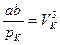 , (9)
, (9)
а також
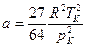 ,
, 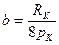 . (10)
. (10)

Рис. 7.5.2
В даній роботі пропонується провести спостереження за проходженням ефіру через критичний стан і знайти середнє значення температур зникнення та появи меніску. Це середнє значення можна вважати критичною температурою. Схема експериментальної установки зображена на рис. 7.5.2
Запаяна скляна ампула 4 з ефіром розміщена всередині сушильної шафи 3, напруга, що подається на нагрівник 5, може змінюватись за допомогою автотрансформатора 6. Температура ефіру вимірюється термометром 2, який підсвічується лампочкою 1.
Хід роботи
1. Перевірити технічний стан установки, увімкнувши лампочку освітлення.
2. При нульовому положенні ручки автотрансформатора ввімкнути його в електричну мережу. Поворотом ручки подати на спіраль нагрівника напругу і підібрати таке її значення, при якому швидкість нагрівання складає близько 50°С за хвилину.
3. Починаючи з температури 150°С безперервно спостерігають за положенням і виглядом меніска в ампулі. Визначивши температуру зникнення меніска Тк1, встановлюють регулятор автотрансформатора на нуль і спостерігають за явищами в ампулі.
4. Визначають температуру Тк2 появи меніска в ампулі при її охолодженні.
Увага! Після ввімкнення нагрівника з метою безпеки не дозволяється відкривати дверцята шафи. Тиск ефіру в ампулі при нагріванні зростає і в критичному стані досягає 35,5 атм.






