Мета: Навчитися розв’язувати експериментальні задачі. Закріпити знання по темі «Метали».
Теоретичні відомості:
Хімічні й фізичні властивості металів визначаються будовою їхніх атомів і особливостями хімічного зв’язку. Загальною хімічною властивістю металів є здатність атомів під час хімічних реакцій віддавати валентні електрони, тобто окислюватись і перетворюватись на позитивно заряджені йони. Отже, метали в реакціях є добрими відновниками. Чим легше атоми металів віддають електрони, тим вони хімічно активніші. Для якісної характеристики хімічної активності металів скористайтеся реакціями витіснення. Хімічний характер будь-якого металу значною мірою зумовлюється тим, наскільки легко його атоми здатні віддавати електрони і перетворюватись на позитивно заряджені йони, тобто наскільки легко метал окиснюється. Для металів характерні такі хімічні властивості:
1. Взаємодія з солями. Активні метали відновлюють менш активні метали з розчинів їхніх солей:
Сu+CuCl2 = ZnCl2+Cu
Cu+2AgNO3 = Cu(NO3)2+2Ag
Цинк і Купрум окислюються йонами Купруму й Арґентуму, тобто катіонами менш активних металів. Отже, Цинк і Купрум -відновники.
2. Взаємодія з неметалами. Метали окиснюються багатьма неметалами. Найбільш енергійно вони реагують з галогенами, Оксигеном і Сульфуром, утворюючи відповідно галогеніди, оксиди, сульфіди:
2Al+3Br2 = 2AlBr3
2Mg+O2 = 2MgO
2Na+S = Na2S
У цих реакціях метали Алюміній, Магній, Натрій- відновники, а неметали Бром, Оксиген, Сульфур -окисники.
3. Взаємодія з водою. Найактивніші метали(Калій, Натрій, Барій, Кальцій) реагують з водою за звичайних умов з виділенням водню та утворенням лугів:
2Na+2H2O = 2NaOH+H2 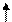
Ba+2H2O = Ba(OH)2+H2
Досить активні метали (Магній, Цинк) реагують з розбавленими розчинами кислот, відновлюючи Гідроген:
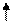 Mg+2HCl = MgCl2+H2
Mg+2HCl = MgCl2+H2
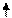 Fe+H2SO4 = FeSO4+H2
Fe+H2SO4 = FeSO4+H2
Отже, в усіх розглянутих випадках взаємодії металів з неметалами, водою, кислотами, солями атоми металів віддають електрони- окислюються, а це означає, що метали як прості речовини є відновниками.
Алюміній - це сріблясто-білий метал, досить легкоплавкий. Для нього характерна висока пластичність, добра електро- та теплопровідність. Взаємодіє з кислотами:
2Al+6HCl=2AlCl3↓+3H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
Взаємодія з лугами. Алюміній реагує з розчинами лугів з виділенням водню й утворенням комплексної солі, наприклад тетраідроксоалюмінату натрію:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
Відновлення оксидів металів. Алюміній- добрий відновник багатьох оксидів металів, наприклад:
2Al+Cr2O3=Al2O3+2Cr
Гідроксид алюмінію взаємодіє з кислотою. Це свідчить про основні властивості гідроксиду алюмінію:
Al(OH)3+3HCl=AlCl3+3H2O
Гідроксид алюмінію взаємодіє і з лугом, що свідчить про його кислотні властивості:
Al(OH)3+NaOН=Na[Al(OH)4]
У розчині ця реакція відбувається з утворенням комплексної солі Na[Al(OH)], а в результаті сплавлення сухих речовин утворюється метаалюмінат натрію:
Al(OH)3+NaOH=NaAlO2+2H2O
Який же висновок можна зробити про кислотно-основні властивості гідроксиду алюмінію? Гідроксид алюмінію Al(OH)-амфотерна сполука: в реакціях з кислотами він виявляє основні властивості. А в реакціях з основами-кислотні.
Ферум гідроксид (ІІ) утворюється внаслідок дії лугів на розчини солей Феруму(ІІ):
FeSO4+2NaOH=Fe(OH)2↑+Na2SO4
Саме так відбувається реакція без доступу повітря. У протилежному разі Ферум (ІІ) гідроксид легко окиснюється до Ферум (ІІІ) гідроксид:
4Fe(OH)2+ O2+ 2H2O=4Fe(OH)3.
Реактиви і обладнання: Алюміній хлорид, Алюміній гідроксид, хлоридна кислота, Натрій гідроксид.
Хід роботи:
Дослід 1. Налийте у пробірку 2-3 мл розчину Алюміній хлориду і добавляйте по краплинах розбавлений розчин Натрій гідроксиду до утворення білого драглистого осаду Алюміній гідроксиду.
Завдання: Напишіть рівняння реакції. Добутий осад поділіть на дві частини, відливши у другу пробірку. У першу пробірку долийте трохи хлоридної кислоти, у другу - надлишок розчину Натрій гідроксиду. Що спостерігається?
Розв’язування експериментальних задач з теми «Метали»
Завдання 1. Виконайте такі перетворення:
Варіант1
А) CuCl2 → Cu(OH)2 → CuO → Cu(NO3)2
Б) виходячи із Феруму, добудьте Ферум хлорид (ІІ).
Варіант 2
А) Fe2O3 → Fe2(SO4)3 → Fe(OH)3 → FeCl3
Б) виходячи з Магнію, добудьте Магній сульфат.
Завдання 2. Напишіть рівняння виконаних реакцій у молекулярній, повній і скороченій йонних формах.
Запитання для захисту лабораторної роботи:
1. Хімічні властивості металів.
2.Алюміній та його амфотерність.
Техніка безпеки
2. Фізіологічні дії реактивів, що використовуються:
Кислоти і луги викликають опіки шкіри, подразнюють органи дихання, руйнують тканини одежі;
Купрум (ІІ) сульфат при попаданні в шлунок викликає отруєння.
2. Міри безпеки:
Не допускати попадання кислот, лугів, солей на шкіру або одежу,
Працювати в халатах.
Не пробувати реактиви на смак.
Використовувати роботу, відповідно до інструкції. Брати реактиви в невеликій кількості.
3.Правила першої допомоги:
Уражене місце кислотою помити великою кількістю води;
При опіках лугом - помити 1% розчином оцтової кислоти;
При опіках кислотами - помити 2% розчином питної води.
Лабораторна робота № 7






