| Показатели | По ГОСТ 10433-63, образцы 1 и 2 | По МРТУ 12Н № 110-64. Образцы 1 и 2 |
| Плотность при 200 С, г/см3 | 0,886 – 0,903 | 0,83 |
| Вязкость кинематическая при 500 С, сст | 2,95 – 3,36 | 1,9 |
| Зольность % | 0,008 | Отсутствует |
| Содержание в % ванадия серы | (1,6 – 6,8) * 10-4 1, - 1,9 | Отсутствует 0,22 – 0,18 |
| Температура 0 С – вспышки застывания | 80 – 82 -12 ÷ - 17 | 68 – 73 -10 ÷ -17 |
В соответствии со спецификацией ASTM 975-68Т дизельные топлива в США производились трех сортов: 1-D -легкий сорт; 2 -D - более тяжёлый (газойлевые фракции); 4-D - тяжёлый сорт - дистиллятные топлива. На топлива, применяемые в армии США, имелась отдельная военная спецификация для быстроходных дизелей. Качество этих топлив соответствует требованиям, предъявляемым к топливам для газовых турбин.
На основании проведенных исследований опытных образцов топлив в США в 1966 году был предложен проект ASTM на топлива для газовых турбин.
Сорта 1 – GT, 2 -GT, 3 – GT - дистиллятные топлива, 4 – GT - остаточные. В нём зольность не ограничивается и допускается высокое содержание ванадия и натрия.
О разработке газотурбинных топлив в других странах известно очень мало. В качестве газотурбинного топлива для стационарных ГТУ используются также мазуты. Качество мазутов оценивается в основном теми же показателями, что и в РФ. В США была распространена спецификация D 396-66Т.
В Англии использовалась спецификация Английского института стандартов BS 2869-1957, которая распространялась на дистиллятные и остаточные топлива (мазуты), получаемые переработкой нефти.
В ФРГ существовала правительственная спецификация в которой различается четыре сорта: EL и L (дистиллятные), М (типа флотского мазута) и S (типа топочного мазута М 60). Отсутствие сведений о содержании зольных элементов в мазутах, вырабатываемых в Англии, ФРГ и других странах не позволяет оценить возможность их применения в качестве газотурбинного топлива.
Контрольные вопросы к главе 2
1. Назовите горючие элементы в топливе ГТД.
2. Укажите физический смысл вязкости топлива.
3. В каких единицах измерения оценивается вязкость керосина и мазута?
ГЛАВА 3. ОСНОВЫ ТЕОРИИ ГОРЕНИЯ
Реакции горения топлива
Горением называется химический процесс окисления топлива, идущий с интенсивным выделением тепла. Организация процесса горения состоит в том, чтобы предельно использовать теплоту сгорания топлива и получить наибольшее тепловыделение в камере сгорания. На процесс сжигания топлива в факеле пламени, особенно на полноту его сгорания, влияют различные условия, которые определяются исходным составом топлива, процессом перемешивания воздуха с топливом, жидким иди газообразным, начальными температурами обоих компонентов, условиями зажигания, размерами камеры. В процессе горения окисляются основные составляющие топлива - углерод и водород, а также примеси.
Основные стехиометрические реакции горения имеют следующий вид:
С + О2 = СО2; 2Н2 + О2 = 2Н20; S + O2 = SO2
12 32 44 4 32 36 32 32 64
Следовательно, для окисления одного килограмма углерода потребуется 8/3 кг кислорода, а для С кг углерода 8/3 С кг кислорода. Для окисления одного килограмма водорода требуется 8 кг O2, а для Н кг Н2 - 8 Н кг кислорода.
Таким образом, для сжигания 1 кг топлива нужно следующее количество кислорода:
8/3 СР + 8Н Р +S Р – O Р, кг.
В окислителе содержится следующее количество свободного кислорода:
ОоР – 8/3ОоР –8 НоР – SоР, кг,
где СР, Н Р,S Р,O Р - массовое содержание элементов в топливе,
ОоР,ОоР,НоР,SоР – массовое содержание элементов в окислителе.
Отношение
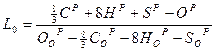 , кг "о"/кг "т"
, кг "о"/кг "т"
Называется стехиометрическим коэффициентом. Величина L0 определяет количество окислителя, необходимого для полного сжигания одного килограмма топлива при идеальных условиях. Обычно окислителем в ГТД является воздух. В этом случае НоР = СоР = SоР и ОоР = 0,232, откуда следует:
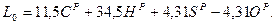
При сгорании керосина, имеющего состав СР =0,86 и НР =0,14 в воздухе стехиометрический коэффициент равен L0 = 14,72.
Пользуясь теми же массовыми соотношениями, можно рассчитать количество отдельных газов, содержащихся в охлажденных продуктах сгорания 1 кг горючего. Так как общая масса продуктов сгорания, получающихся при сжигании 1 кг горючего (топлива), равна

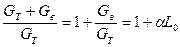 , кг "пс"/кг "т",
, кг "пс"/кг "т",
то относительная массовая доля какого-либо компонента в продуктах сгорания равна gi=Gi|1+αL0:
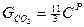 ,
, 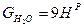 ,
, 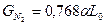 ,
, 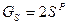 ;
;
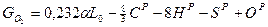 .
.
Для реакций окисления углерода и водорода можно написать следующие массовые соотношения:
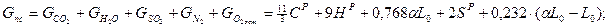
Где НР, СР, SР - массовые количества углерода, водорода и серы в топливе. При условии полного сгорания и α = 1 продукты сгорания состоят из СО2 + SO2 и Н20. Для продуктов сгорания одного килограмма топлива с СР = 0,86 и НР = 0,14 имеем:
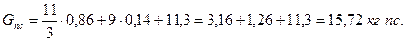
Проверка вычислений даёт следующий результат:
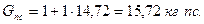
Степень совершенства горения устанавливается газовым анализом. С помощью газового анализа продуктов сгорания можно определить их детальный состав, включая и непрореагировавшее горючее. На практике ограничиваются измерением количества остаточного кислорода для определения двух главных характеристик камер сгорания – суммарного коэффициента избытка воздуха 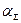 и коэффициента полноты сгорания ηг. Коэффициент избытка воздуха в точке отбора пробы равен
и коэффициента полноты сгорания ηг. Коэффициент избытка воздуха в точке отбора пробы равен
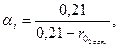
где 0,21 - объемная доля кислорода в воздухе,
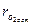 =
= 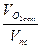 - отношение объема O2 ост к общему объему продуктов сгорания после дожигания пробы. Формула для
- отношение объема O2 ост к общему объему продуктов сгорания после дожигания пробы. Формула для 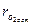 имеет вид:
имеет вид:
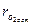 =
= 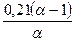 ,
,
где полагается, что объем воздуха приблизительно равен объему продуктов сгорания. Формула определяет количество кислорода, оставшегося после стехиометрического сжигания 1 кг топлива.
Коэффициент химической полноты сгорания, если приближенно принять, что количество выделившегося тепла пропорционально количеству поглощенного кислорода, равен:

ηг= 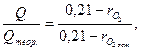
где 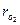 - объемная доля О2 в "замороженной" пробе (без дожигания), то есть это лишний кислород плюс оставшийся из-за плохой организации процесса горения.
- объемная доля О2 в "замороженной" пробе (без дожигания), то есть это лишний кислород плюс оставшийся из-за плохой организации процесса горения.
Методы газового анализа в настоящее время хорошо разработаны и могут быть изучены по специальной литературе.
Таким образом, по измеренным величинам 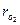 и
и 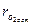 можно вычислить α и ηг в точке отбора пробы и затем проинтегрировать по сечению:
можно вычислить α и ηг в точке отбора пробы и затем проинтегрировать по сечению:
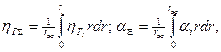
где rж - радиус жаровой трубы.
При отсутствии ошибок эти рабочие параметры работы камеры должны совпасть с параметрами, определенными по суммарным величинам.
Так как скорость химической реакции весьма велика, то скорость сгорания практически равна скорости смесеобразования.
В общем случае полное время сгорания топлива равняется
τc = τ см + τ t + τ x
где τсм - время смесеобразования;
τ t - время нагрева до воспламенения;
τ x - время химической реакции.
Если топливо вводится в камеру сгорания неперемешанным, то
τcм ≥ τ t ≈ τ x и τc ≈ τ см.
В этом случае процесс горения часто называется диффузионным.
Если топливо заранее перемешано с воздухом, то
τ см + τ t ≈ τ x и τc ≈ τ x.
В этом случае процесс горения называется кинетическим, так как перестает зависеть от факторов смешения, а скорость процесса определяется скоростью химической реакции.






