2.1. ОСНОВНЫЕ ФОРМУЛЫ И ЗАКОНЫ
Молекулярная физика
Количество вещества (молей) однородного газа находится так:
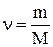 , или
, или 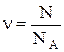 ,
,
где N – число молекул газа; NA – постоянная Авогадро; m – масса газа; М – молярная масса газа.
Если система представляет собой смесь нескольких газов, то количество вещества системы равно
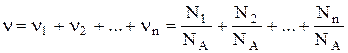 ,
,
или
 ,
,
где nn, Nn, mn, Mn – соответственно количество вещества, число молекул, масса, молярная масса n-го компонента смеси.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона):

 ,
,
где m – масса газа; М – молярная масса газа; R – молярная газовая постоянная; n – количество вещества; Т – термодинамическая температура.
Законы, описывающие состояние газов на основании опытов и являющиеся частными случаями уравнения Менделеева-Клапейрона, для изопроцессов таковы:
а) закон Бойля-Мариотта (изотермический процесс: Т=const, m=const): рV=const, или для двух состояний газа p1V1=p2V2;
б) закон Гей-Люссака (изобарный процесс: p=const, m=const): 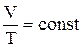 , или для двух состояний
, или для двух состояний 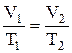 ;
;
в) закон Шарля (изохорный процесс: V=const, m=const):  , или для двух состояний
, или для двух состояний 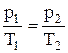 ;
;
г) объединенный газовый закон (m=const): 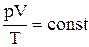 , или
, или 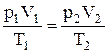 , где р1, V1, Т1 – соответственно давление, объем и температура газа в начальном состоянии; р2, V2, Т2 – те же величины в конечном состоянии.
, где р1, V1, Т1 – соответственно давление, объем и температура газа в начальном состоянии; р2, V2, Т2 – те же величины в конечном состоянии.
Закон Дальтона определяет давление смеси газов: р=р1+р2+…+рn, где рn – парциальные давления компонентов смеси; n – число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он находился в сосуде, занятом смесью.
Молярная масса смеси газов:
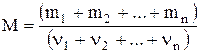 ,
,
где mn – масса n-го компонента смеси; 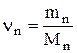 – количество вещества n-го компонента смеси; n – число компонентов смеси.
– количество вещества n-го компонента смеси; n – число компонентов смеси.
Массовая доля wn n-го компонента смеси газа в долях единицы или процентах находится так:
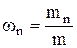 ,
,
где m – масса смеси.
Концентрация молекул:
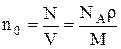 ,
,
где N – число молекул, содержащихся в данной системе; r – плотность вещества; V – объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение кинетической теории газов:
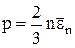 ,
,
где 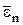 – средняя кинетическая энергия поступательного движения молекулы.
– средняя кинетическая энергия поступательного движения молекулы.
Средняя кинетическая энергия поступательного движения молекулы:
 ,
,
где k – постоянная Больцмана.
Средняя полная кинетическая энергия молекулы:
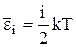 ,
,
где i – число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры такова:
p=nkT.
Скорость молекул:
среднеквадратичная 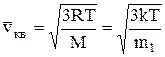 ;
;
среднеарифметическая  ;
;
наиболее вероятная  ,
,
где m1 – масса одной молекулы.
Относительная скорость молекулы:
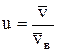 ,
,
где  – скорость данной молекулы.
– скорость данной молекулы.
Среднее число соударений, испытываемых одной молекулой газа в единицу времени, –
 ,
,
где d – эффективный диаметр молекулы; n – концентрация молекул;  – среднеарифметическая скорость молекул.
– среднеарифметическая скорость молекул.
Средняя длина свободного пробега молекул газа –
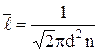 .
.
Удельные теплоемкости газа при постоянном объеме (сv) и постоянном давлении (ср):
 .
.
Связь между значениями удельной с и молярной С теплоемкости:
 .
.
Уравнение Майера:
Ср-Сv=R.
Внутренняя энергия идеального газа:
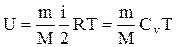 .
.






