| Вещество | Состояние | S 0298, Дж/моль×К | Вещество | Состояние | S 0298, Дж/моль×К |
| C | Алмаз | 2,44 | NH3 | г | 192,50 |
| С | Графит | 5,69 | CO | г | 197,91 |
| S | Ромб. | 31,9 | C2H2 | г | 200,82 |
| FeO | к | 54,0 | O2 | г | 205,03 |
| H2O | ж | 69,94 | H2S | г | 205,64 |
| NH4Cl | к | 94,5 | NO | г | 210,20 |
| CH3OН | ж | 126,8 | CO2 | г | 213,65 |
| H2 | г | 130,59 | C2H4 | г | 219,45 |
| Fe3O4 | к | 146,4 | Cl2 | г | 222,95 |
| CH4 | г | 186,19 | NO2 | г | 240,46 |
| HCl | г | 186,68 | PCl3 | г | 311,66 |
| H2O | г | 188,72 | PCl5 | г | 352,71 |
| N2 | г | 191,49 |
Пример 3. На основании стандартных теплот образования (табл. 1) и абсолютных стандартных энтропий веществ (табл. 3) вычислите D G0298 реакции, протекающей по уравнению:.
СО(г) + Н2О(ж) = СО2(г) + Н2(г)
Решение. D G ° = D H ° – T D S °; D H и D S – функции состояния, поэтому:
D Н °х..р.= SD Н °прод–SD Н °исх ; D S °.х.р.= S S °прод–S S °исх.
D Н °х.р.= (–393,51 + 0) – (–110,52 – 285,84) = + 2,85 кДж;
D S °х.р.= (213,65 + 130,59) – (197,91 + 69,94) = + 76,39 =0,07639 кДж/моль × град;
D G ° = + 2,85 – 298(0,07639) = – 19,91 кДж
Пример 4. Восстановление Fe2О3 водородом протекает по уравнению:
Fe2О3(к) + ЗН2(г) = 2Fe(к) + ЗН2O(г); D Н =.+96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии D S = 0,1387 кДж/моль×К? При какой температуре начнется восстановлениеFe2О3?
Решение. Вычисляем D G ° реакции: D G = D H – T D S = 96,61 – 298(0,1387) = +55,28 кДж. Так как D G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой D G = 0:
D H = T D S; T = D H/ D S = 96,61/0,1387= 696,5 К.
Следовательно, при температуре» 696,5° К начнется реакция восстановления Fe2О3. Иногда эту температуру называют температурой начала реакции.
81. Теплоты образования D Н °298 оксида и диоксида азота соответственно равны +90,37 кДж и +33,85 кДж. Определите D S °298 и D G °298 для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему?
Ответ: +11,94 Дж/моль×К; –60,315 Дж/моль×К; +86,81 кДж; +51,82 кДж.
82. При какой температуре наступит равновесие системы 4НСl(г)+О2(г) ⇄ 2H2О(г) + 2Cl2(г); D Н = –114,42 кДж? Что в этой системе является более сильным окислителем: хлор или кислород и при каких температурах?
Ответ; 891 К.
83. Восстановление Fe3О4 оксидом углерода идет по уравнению Fe3О4(к) + СО(г) = 3FeO(к) + СО2(г). Вычислите D G °298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно D S °298 в этом процессе?
Ответ: +24,19 кДж; +31,34 Дж/моль×К.
84. Реакция горения ацетилена идет по уравнению
С2Н2(г) = 5/2О2(г) = 2СО2(г) + Н2О(ж)
Вычислите D G °298 и D S °298 объясните уменьшение энтропии в результате этой реакции.
Ответ: –1235,15 кДж; –216,15 Дж/моль×К.
85. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите D S °298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
Ответ: а) 118,78 Дж/моль×К; б) –3,25 Дж/моль×К.
86. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция, протекающая до уравнению:
Н2(г) + СО2(г) = СО(г) + Н2О(ж); D Н = –2,85 кДж.
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите D G 0298 этой реакции.
Ответ: +19,91 кДж.
87. Прямая или обратная реакция будет протекать при стандартных условиях в системе:
2NO(г) + O2(г) ⇄ 2NO2(г)
Ответ мотивируйте, вычислив D G 0298 прямой реакции.
Ответ:–69,70 кДж.
88. Исходя из значений стандартных теплот образований и абсолютных стандартных энтропий соответствующих веществ вычислите D G 0298 реакции, протекающей по уравнению
NH3(г) + HCI(г) = NH4Cl(к)
Может ли эта реакция при стандартных условиях идти самопроизвольно?
Ответ :– 92,08 кДж.
89. При какой температуре наступит равновесие системы
СО(г) + 2H2(г) = СН3ОН(ж); D Н = –128,05 кДж?
Ответ:» 385,5 К.
90. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению:
СН4(г) + СО2(г) = 2СО(г) + 2Н2(г); D Н=+ 247,37 кДж.
При какой температуре начнется эта реакция?
Ответ:» 961,9 К.
91. Определите D G 0298 реакции, протекающей по уравнению:
4NH3(г) + 5O2(г) = 4NO(г) +6Н2О(г)
Вычисления сделайте на оснований стандартных теплот образования и абсолютных стандартных энтропий cоответствующих веществ. Возможна ли эта реакция при стандартных условиях?
Ответ: – 957,77 кДж.
92. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите D G °298 реакции, протекающей по уравнению:
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж)
Возможна ли такая реакция при стандартных условиях?
Ответ:–130,89 кДж.
93. Вычислите изменение энтропии в результате реакции образования аммиака из азота и водорода. При расчете можно исходить из S °298 соответствующих газов, так как DS с изменением температуры изменяется незначительно. Чем можно объяснить отрицательные значения DS?
Ответ: –198,26 кДж/моль×K.
94. Какие из карбонатов: BeCO3 , СаСО3 или BàCO3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергичнее? Вывод сделайте, вычислив D G °298 реакций.
Ответ: +31,24 кДж; –130,17 кДж; –216,02 кДж.
95. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите D G °298 реакций, протекающей по уравнению
СО(г) + ЗН2(г) = СН4(г) + Н2О(г)
Возможна ли эта реакция при стандартных условиях?
Ответ: –142,16 кДж.
96. Образование сероводорода из простых веществ протекает по уравнению
Н2(г) + S ромб =H2S(г); D Н= –20,15 кДж.
Исходя из значений S °298 соответствующих веществ определите D S °298 и D G °298 для этой реакции.
Ответ: +43,15 Дж/моль×K; –33,01 кДж.
97. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите D G °298 реакции, протекающей по уравнению
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж)
Возможна ли эта реакция при стандартных условиях?
Ответ: –1331,21 кДж
98. Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению
Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г); D H = +34,55 кДж.
Ответ: 1102,4 К.
99. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающих по уравнениям:
PCl5(г) = PCl3(г) + Cl2(г); D H = +92,59 кДж.
Ответ: 509 К.
100. Вычислите изменение энтропии для реакций, протекающих по уравнениям
2СН4(г) = С2Н2(г) + 3Н2(г)
N2(г) + 3Н2(г) = 2NН3(г)
Сграфит + О2(г) = СО2(г)
Почему в этих реакциях D S °298 > 0; < 0; @ 0?
Ответ: 220,21 Дж/моль×K; –198,26 Дж/моль×K; 2,93 кДж/моль×K.
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Кинетика - учение о скорости различных процессов, в том числе химических реакции. Критерием принципиальной осуществимости реакции является неравенство D Gр,Т < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, (D G 0298)Н2О(г)= –228,59 кДж/моль×K, (D G 0298)АlI3(к)= –313,8 кДж/моль и, следовательно, при Т = 298 К и р = 1 атм возможны реакции, идущие по уравнениям:
Н2(г) + ½О2(г) = Н2О(г) (1)
2Al(к) + 3I2(к) = 2AlI3(к) (2)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический “тормоз”, и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых – концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г)+О2(г) = 2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентраций реагирующих веществ: [SO2] = a, [O2] = b, [SO3] = с, Согласно закону действия масс скорости (V) прямой и обратной реакции до изменения объема
V пр = Ка 2 b;
V обр = K 1 c 2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3 a, [O2] = 3 b, [SO3] = 3 с. При новых концентрациях скорости (V /) прямой и обратной реакции:
V /пр = К (3 а)2(3 b) = 27 Ka 2 b;
V /обр = К 1(3 с)2 = 9 К 1 с 2.
Отсюда

Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз. Равновесие системы сместилось в сторону образования серного ангидрида.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 ° С до 70 ° С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант – Гоффа по формуле:


Следовательно, скорость реакции (Vt 2), протекающей при температуре 70° С, увеличилась по сравнение со скоростью реакции (Vt 1), протекающей при температуре 30° С, в 16 раз.
Пример 3. Константа равновесия гомогенной системы
СO(г) + H2O(г) ⇄ CO2 (г) + H2(г)
при 850° С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей есть величина постоянная и называется константой равновесия данной системы:
V пр=К1[CO][H2O];
V обр=К2[CO2][H2];

В условии задачи даны исходные концентрации, тогда как в выражение К равн входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО2]равн = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л.) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
[CO]равн = [Н2]равн= х моль/л;
[CO]равн = (3 – х) моль/л;
[Н2О]равн = (2 – х) моль/л.
Зная константу равновесия, находим значение х, а затем и исходные концентрации всех веществ:
1 = x 2/(3 – x)(2 – x)
х 2 = 6 – 2 х – 3 х + х 2; 5 х = 6, х = 1,2 моль/л.
Таким образом, искомые равновесные концентрации:
[СО2]равн = 1,2 моль/л;
[Н2]равн = 1,2 моль/л;
[СО]равн = 3 – 1,2 = 1,8 моль/л;
[Н2О]равн = 2 – 1,2 = 0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РСI5(г) ⇄ РСI3(г) + CI2(г); ∆ H = +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения РСI5 ?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РСI5 эндотермическая (∆ H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСI5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСI5, так и уменьшением концентрации РСI3 или СI2.
101. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + О2(г) = SO2(г); б) 2SO2(г) + O2(г) = 2SO3(г). Как изменяются скорости этих реакций, если объемы каждой из систем уменьшить в 4 раза?
102. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 ⇄ 2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в 3 раза?
123. Реакция идет по уравнению N2 + О2 ⇄ 2NО. Концентрации исходных веществ до начала реакции были: [N2] = 0,049 моль/л; [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] стала равной 0,005 моль/л.
Ответ: [N2] = 0,0465 моль/л; [O2] = 0,0075 моль/л.
104. Реакция идет по уравнению N2 + 3H2 = 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л; [H2] = 1,5 моль/л; [NH3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] стала равной 0,50 моль/л.
Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
105. Реакция идет по уравнению Н2 + I2 = 2HI. Константа скорости этой реакции при 508 ° С равна 0,16. Исходные концентрации реагирующих веществ были: [H2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [H2] стала равной 0,03 моль/л.
Ответ: 3,2 10–4; 1,92 10–4.
106. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80° С. Температурный коэффициент скорости реакции равен трем.
107. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 град, если температурный коэффициент скорости данной реакции равен двум?
108. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 30 град, если температурный коэффициент скорости данной реакции равен трем?
109. Напишите выражение для константы равновесия гомогенной системы 2SO2 + O2 ⇄ 2SO3. Как изменится скорость прямой реакции – образования серного ангидрида, если увеличить концентрацию SO2 в 3 раза?
110. Напишите выражение для константы равновесия гомогенной системы СН4 + СО ⇄ 2Н2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция – образования водорода эндотермическая.
111. Реакция идет по уравнению 2NO + O2 = 2NO2. Концентрации исходных веществ были: [NO] = 0,03 моль/л; [O2] = 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,10 моль/л и концентрацию NO до 0,06 моль/л?
112. Напишите выражение для константы равновесия гетерогенной системы: СО2 + С = 2СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
113. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ⇄ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
114. Равновесие гомогенной системы 4НСI(г) + О2(г) ⇄ 2Н2О(г) +2СI2(г) установилось при следующих концентрациях реагирующих веществ: [Н2О] = 0,14 моль/л; [CI] = 0,14 моль/л; [HCI2] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлористого водорода и кислорода.
Ответ: [HCI]исх = 0,48 моль/л; [O2]исх = 0,39 моль/л.
115. Вычислите константу равновесия для гомогенной системы СО(г) + Н2О(г) ⇄ СО2(г) + Н2(г), если равновесные концентрации реагирующих веществ: [CО] = 0,004 моль/л; [Н2О] = 0,064 моль/л; [CО2] = 0,016 моль/л; [Н2] = 0,016 моль/л.
Ответ: К = 1.
116. Константа равновесия гомогенной системы СО(г) + Н2О(г)⇄ CO2(г) + Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации; [CО] = 0,10 моль/л; [Н2О] = 0,40 моль/л.
Ответ: [CО2] = [Н2] = 0,08 моль/л; [CО] = 0,02 моль/л; [Н2О] = 0,32 моль/л.
117. Константа равновесия гомогенной системы N2 + 3H2 ⇄ 2NH3 при температуре 400° С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны: 0,2 моль/л и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
Ответ: 8 моль/л; 8,04 моль/л.
118. При некоторой температуре равновесие гомогенной системы 2NO + O2 ⇄ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и O2.
Ответ: К = 2,5: [NO] = 0,3 моль/л; [O2] = 0,15 моль/л.
119. Почему при изменении давления смещается равновесие системы N2 + H2 ⇄ 2NH3 и не смещается равновесие системы N2 + O2 ⇄ 2NO? Напишите выражения для констант равновесия каждой из данных систем.
120. Исходные концентрации NО и CI2 и в гомогенной системе 2NO + CI2 ⇄ 2NOCI составляют соответственно: 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
Ответ: 0,416
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном весовом или объемном количестве раствора или растворителя,
Пример 1. Массовая доля растворенного вещества,
Определите массовую долю (%) хлорида калия в растворе, содержащем 0,053 кг КС1 в 0,5 л раствора, плотность которого 1,063 г/см 3.
Решение. Массовая доля w показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:

где w - массовая доля (%) растворенного вещества; m 1 – масса растворенного вещества, г; m – масса раствора, г.
Масса раствора равна произведению объема раствора V на его плотность r:
m = rV, тогда
ω = (m 1/ r V)100%
Массовая доля хлорида калия в растворе равна:

Пример 2. Молярная концентрация раствора.
Какова масса КОН, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,4 моль/л?
Решение. Молярная концентрация или молярность (С м) раствора показывает количество молей растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию (моль/л) выражают формулой
С м = m 1/ M ×V,
где m 1 – масса растворенного вещества, г; М – молярная масса растворенного вещество, г/моль; V – объем раствора, л.
М (КОН) = 56,1 г/моль. Масса КОН содержащегося в растворе, равна m = M ×V;× C M = 56,1×0,2×0,4 = 4,5 моль/л.
Пример 3. Молярная концентрация эквивалента (С н) или нормальная концентрация.
Определите молярную концентрацию эквивалента хлорида алюминия, если в 0,5 л раствора содержится 33,33 г AlCI3.
Решение. Молярная концентрация эквивалента (нормальность раствора) показывает число молярных масс эквивалентов растворенного вещества, содержащегося в 1 л раствора (моль/л).
СН = m 1/ V × Э,
где m 1 – масса растворенного вещества, г; Э – молярная масса эквивалента растворенного вещества, г/моль; V – объем раствора, л.
Молярная масса эквивалента равна
Э = М (AlCI3)/3 = 133,33/3 = 44,44 г/моль.
Молярная концентрация эквивалента раствора AlCI3 равна
СН = 33,33/44,44×0,5 = 1,5 моль/л.
Пример 4. Моляльность раствора
Определите моляльную концентрацию раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см 3 воды.
Решение. Моляльность раствора (Сm) показывает количество молей растворенного вещества, содержащихся в 1000 г растворителя.
Массу Н3РО4 в 1000 г растворителя находим из соотношения

х = (1000×18)/282 = 63,83 г.
Молярная масса Н3РО4 равна 97,99 г, отсюда
Сm = 63,83/97,99 = 0,65 м.
Пример 5. Титр раствора (Т)
Определите титр 0,01 н раствора NaOH.
Решение. Титр раствора показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л 0,01 Н раствора NaOH содержится 0,40 г NaOH. Титр этого раствора равен:
Т = 0,40/1000 = 0,0004 г/мл.
Пример 6. На нейтрализацию 50 см 3 раствора кислоты из расходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы раствора реагирующих веществ обратно пропорциональны их нормальностям, т.е.: V 1/ V 2 = CH2/CH1, или V1×CH1= V2CH2, 50×CH1 = 25×0,5 откуда СН2 = 25×0,5/50=0,25 н.
Пример 7. К 1 л 10%-ного раствора КОН (плотность 1,092 г/см 3) прибавили 0,5 л 5%-ного раствора КОН (плотность 1,045 г/см 3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10 %-ного раствора КОН 1092 г. В этом растворе содержится
1092×10/100 = 109,2 г КОН
Масса 0,5 л 5%-ного раствора 1045×0,5 = 522,5 г. В этом растворе содержится
522,5×5/100 = 25,125 г КОН.
В общем объеме полученного раствора (2 л) масса КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярность этого раствора СМ = 135,325/2×56,1 = 1,2 М, где 56,1 – молекулярный вес КОН.
Пример 8. Какой объем 96%-ной кислоты, плотность которой 1,84 г/см 3, потребуется для приготовления 3 л 0,4 н раствора?
Решение. Эквивалент Н2SO4 = M/2 = 98,08/2 = 49,04. Для приготовления 3 л 0,4 н раствора требуется 49,04×0,4×3 = 58,848 г Н2SO4. Масса 1 см 3 96%-ной кислоты 1,84 г. В этом растворе содержится
1,84×96/100 = 1,766 г H2SO4
Следовательно для приготовления 3 л 0,4 н раствора надо взять 58,848: 1,7660 = 33,32 см 3 этой кислоты.
121. Вычислите молярную и нормальную концентрации 20%-ного раствора хлорида кальция, плотность которого 1,178 г/см 3.
Ответ: 2,1 М; 4,2 н.
122. Чему равна нормальность 30%-ного раствора NaOH, плотность которого 1,328 г/см 3?. К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю NaOH концентрации полученного раствора.
Ответ: 9,96 н.; 6,3%.
123. К 3 литрам 10%-ного раствора НNO3 , плотность которого 1,054 г/см 3, прибавили 5 л 2%-ного раствора той же кислоты с плотностью 1,009 г/см 3. Вычислите массовую долю НNO3 и молярную концентрацию полученного раствора, если считать, что его объем равен 8 л.
Ответ: 5,0 %; 0,82 М.
124. Вычислите нормальную и моляльную концентрации 20,8%-ного раствора НNO3 плотность которого 1,12 г/см 3. Сколько граммов кислоты содержится 4 л этого раствора?
Ответ: 3,70 н.; 4,17, 931,8 г.
125. Вычислите молярную, нормальную и моляльную концентрации 16%-ного раствора хлорида алюминия плотность которого 1,149 г/см 3.
Ответ: 1,38 М; 4,14 н.; 1,43 м.
126. Сколько и какого вещества останется в избытке, если к 75 см 3 0,3 н раствора Н2SO4 прибавить 125 см 3 0,2 н раствора КОН?
Ответ: 0,14 г КОН.
127. Для осаждения в виде AgCI всего серебра, содержащегося в 100 см 3 раствора AgNO3 , потребовалось 50 см 3 0,2 н раствора НCI. Чему равна нормальность раствора AgNO3 ? Сколько граммов AgCI выпало в осадок?
Ответ: 0,1 н; 1,433 г.
128. Какой объем 20,01%-ного раствора HCI (плотность 1,100 г/см 3) требуется для приготовления 1 л 10,17%-ного раствора (плотность 1,050 г/см 3)?
Ответ: 485,38 см 3.
129. Смешали 10 см 3 10 %-ного раствора HNO3 (плотность 1,056 г/см 3) и 100 см 3 30%-ного раствора HNO3 (плотность 1,184 г/см 3). Вычислите массовую долю НNO3 в полученном растворе.
Ответ: 28,38%
130. Какой объем 50%-ного раствора КОН (плотность 1,538 г/см 3) требуется для приготовления 3 л 6%-ного раствора (плотность 1,048 г/см 3)?
Ответ: 245,5 г/см 3.
131. Какой объем 10%-ного раствора карбоната натрия Na2CO3 (плотность 1,105 г/см 3) требуется для приготовления 5 л 2%-ного раствора (плотность 1,02 г/см 3)?
Ответ: 923,1 см 3.
132. На нейтрализацию 31 см 3 0,16 н раствора щелочи требуется 217 см 3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4?
Ответ: 0,023 н; 1,127×10-3 г/см 3.
133. Какой объем 0,3 н раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см 3?
Ответ: 26,6 см 3.
134. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см 3 раствора кислоты. Вычислить нормальность раствора кислоты.
Ответ: 0,53 н.
135. Сколько граммов НNO3 содержалось в растворе, если на нейтрализацию его потребовалось 35 см 3 0,4 н раствора NaOH? Чему равен титр раствора.
Ответ: 0,882 г, 0,016 г/см 3.
136. Сколько граммов NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор?
Ответ: 100 г.
137. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCI. Чему равна массовая доля NaCl в полученном растворе?
Ответ: 32,5%.
138. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля H2SO4 в растворе после смешения?
Ответ: 45,72%.
139. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
Ответ: 84%.
140. Из 19 кг 20%-ного раствора при охлаждении выделялось 400 г соли. Чему равна массовая доля соли в охлажденном растворе?
Ответ: 16,7%.
СВОЙСТВА РАСТВОРОВ
Пример 1. Вычислить температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆ t) по сравнению с температурами кристаллизации и кипения растворителя выражается уравнением:
∆ t = 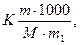 (1)
(1)
где К – криоскопическая или эбуллиоскопическая константы. Для воды они соответственно равны 1,86 и 0,52 град; m и М – соответственно масса растворенного вещества и его молекулярный вес; m 1 – масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора

Вода кристаллизуется при 0° С, следовательно, температура кристаллизации раствора 0 – 0,21= –0,21° С.
Из формулы (1) повышение температуры кипения 2%-ного раствора С6Н12О6

Вода кипит при 100° С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06 ° С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529 ° С. Температура кипения сероуглерода 46,38° С. Вычислить эбуллиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения ∆ t = 46,529 – 46,3 = 0,299 град. Грамм-молекула бензойной кислоты 122 г. Из формулы (1) находим эбуллиоскопическую константу:

Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при –0,279 ° С. Вычислить молекулярный вес глицерина.
Решение. Температура кристаллизации чистой воды 0° С, следовательно, понижение температуры кристаллизации ∆ t = 0 – (–0,279) = 0,279 град. Масса глицерина m (г), приходящаяся на 1000 г воды,

Подставляя в уравнение
 (2)
(2)
данные, вычисляем грамм-молекулярный вес глицерина:

Пример 4. Вычислить массовую долю мочевины (NН2)2CO в водном ра-творе, зная, что температура кристаллизации этого раствора равна –0,465 ° С .
Решение. Температура кристаллизации чистой воды 0 ° С, следовательно, ∆ t = 0 – (–0,465) = 0,465 град. Зная, что грамм-молекула мочевины 60 г, находим массу m (г) растворенного вещества, приходящуюся на 1000 г воды, из формулы (2):
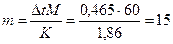
Общий вес раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения
В 1015 г раствора – 15 г вещества
В 100 г раствора – х г вещества
 х = 1,48 %
х = 1,48 %
141. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296 ° С. Температура кристаллизации бензола 5,5° С. Криоскопическая константа 5,1 град. Вычислите молекулярный вес растворенного вещества.
142. Вычислите массовую долю сахара С12Н22О11 в водном растворе, зная температуру кристаллизации раствора (–0,93 ° С). Криоскопическая константа воды 1,86 град.
Ответ: 14,6%.
143. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86 град.
144. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714 ° С. Температура кипения бензола 80,2° С. вычислите эбуллиоскопическую константу бензола.
145. Вычислите массовую долю глицерина С3Н5(ОН)3 в водном растворе, зная, что этот раствор кипит при 100,39 ° С. Эбуллиоскопическая константа воды 0,52 град.
Ответ: 6,45%.
146. Вычислите молекулярный вес неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при –0,279° С . Криоскопическая константа воды 1,86 град.
147. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2 ° С. Эбуллиоскопическая константа его 2,57 град.
Ответ: 81,25 ° С .
148. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465° С. Вычислите молекулярный вес растворенного вещества. Криоскопическая константа воды 1,86 град.
149. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 ° С . Температура кристаллизации уксусной кислоты 16,65 ° С.
150. Равные весовые количества камфоры С10Н16О и нафталина С10Н8 растворены в одинаковых количествах бензола. Какой из растворов кипит при более высокой температуре?
151. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна –0,558° С . Вычислите молекулярный вес растворенного вещество. Криоскопическая константа воды 1,86 град.
152. Сколько граммов анилина С6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53 град? Эбуллиоскопическая константа этилового эфира 2,12 град.
Ответ: 1,16 г.
153. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН, зная, что криоскопическая константа воды 1,86 град.
Ответ: –0,82° С .
154. Сколько граммов мочевины (NH2)2CO следует растворить 75 г воды, чтобы температура кристаллизации понизилась на 0,465 град?
Ответ: 1,12 г.
155. Вычислите массовую долю глюкозы С6Н12О6, в водном растворе зная, что этот раствор кипит при 100,26 ° С. Эбуллиоскопическая константа воды 0,52 град.
Ответ: 8,25%.
156. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 град? Криоскопическая константа бензола 5,1 град.
Ответ: 3,91 г.
157. Сколько граммов мочевины (NH2)2CO, следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26 град? Эбуллиоскопическая константа воды 0,52 град.
Ответ: 7,5 г.
158. При растворении 2,3 г некоторого неэлектролита в125 г воды температура кристаллизации понижается на 0,372 град. Вычислите молекулярный вес растворенного вещества. Криоскопическая константа воды 1,86 град.
159. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН, зная, что эбуллиоскопическая константа воды 0,52 град.
Ответ: 101,52° С .
160. Вычислите массовую долю метанола СН3ОН в водном растворе, температура кристаллизации которого –2,79° С . Криоскопическая константа воды 1,86 град.
Ответ: 4,58%.
ИОННЫЕ РЕАКЦИИ ОБМЕНА
При химической реакции в растворах электролитов взаимодействуют не молекулы, а ионы. Например, уравнение реакции в молекулярной форме:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
уравнение в полном ионном виде, или полное ионное уравнение:
Ba2+ + 2NO3– + 2H+ + SO42– = BaSO4↓ + 2NO3–
уравнение в сокращенном ионном виде, или сокращенное ионное уравнение:
Ba2+ + SO42– = BaSO4↓.
Протекание реакции между электролитами возможно в трех случаях:
1. Если ионы, соединяясь, образуют труднорастворимое соединение.
Например:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + SO42– + 2Na+ + 2OH– = Cu(OH)2↓ +2Na+ + SO42–,
Cu2+ + 2OH– = Cu(OH)2↓.
2. Если при взаимодействии ионов образуется летучее вещество. Например:
Na2S + 2HCl = 2NaCl + H2S↑
2Na+ + S2– + 2H+ + 2Cl– = 2Na+ + 2Cl– + H2S↑
S2– + 2H+ = H2S ↑
3. Если при взаимодействии ионов образуется малодиссоциирующий электролит. Например:
NaOH + HCl = NaCl + H2O
Na+ + OH– + H+ + Cl– = Na+ + Cl– + H2O
H+ + OH– = H2O
При всех подобных реакциях взаимодействие между данными ионами происходит независимо от присутствия других, не участвующих в реакции ионов.
Соединения выпадающие в осадок, газообразные и малодиссоциирующие, в ионных уравнениях записываются в молекулярной форме.
161. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами NaHCO3 и NaOH; К2SiO3 и HCI; ВаСI2 и Na2SO4.
162. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами К2S и HCI; FeSO4 и (NH4)2S; Cr(OH)3 и KOH.
163. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Zn2+ + H2S = ZnS + 2H+
Mg2+ + CO32– = MgCO3
H+ + OH– = H2O
164. К каждому из веществ: Al (OH)3; H2SO4; Ba(OH)2 – прибавили раствор едкого кали. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
165. Составьте молекулярные и ионные уравнения реакции, протекающих между веществами КНСО3 и Н2SO4; Zn(OH)2 и NaOH; CaCI2 и AgNO3.
166. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами CuSO4 и H2S; BaCO3 и HNO3; FeCI3 и КОН.
167. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Cu2+ + S2– = CuS
Pb(OH)2 + 2OH– = PbO22– + 2H2O
SiO32– + 2H+ = H2SiO3
168. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Sn(OH)2 и HCI; BeSO4 и KOH; NH4CI и Ba(OH)2.
169. К каждому из веществ: КНСО3, СН3СООН, NiSO4, NaS – прибавили раствор серной кислоты. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
170. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Нg(NO3)2 и NaI; Pb(NO3)2 и KI; CdSO4 и Na2S.
171. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
CaCO3 + 2H+ = Ca2+ + H2O + CO2
Al(OH)3 + OH– = AlO2– + 2H2O
Pb2+ + 2I– = PbI2
172. Составьте молекулярные и ионные уравнения реакций растворения дигидроксида бериллия в растворе едкого натра; дигидроксида меди в растворе азотной кислоты.
173. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Na3PO4 и CaCI2; К2СО3 и ВаСI2; Zn(OH)2 и КОН.
174. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Fe(OH)3 + ЗH+ = Fе3+ + ЗН2O
Сd2+ + 2ОН-= Сd(ОН)2
H+ +NNO2– = НNО2
175. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами СdS и НСI; Сг(ОН)3 и NаОН; Ва(ОН)2 и СоСI2.
176. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Zn2+ + Н2S = ZnS + 2Н+
НСО3- + Н+ = Н2O + СО2
Ag+ + СI- = AgСI
177. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами Н2SО4 и Ва(ОН)2; FеС13 и NH4ОН; СН3СООNа и НСI.
178. Составьте молекулярные и ионные уравнений реакций, протекающих между веществами FеСI3 и КОH; NiSO4 и (NH4)2S; MgСО3 и НNO3.
179. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
Bе(ОН)2 + 2OН– = ВеО22– + 2Н2O
СН3СОО– + Н+ = СН3СООН
Ва2+ + SO42– = ВаSO4
180. K каждому из веществ: NаСI, NiSO4, Ве(ОН)2, КНСО3 – прибавили раствор гидроксида натрия. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
Гидролиз солей
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза соли в растворе появляется некоторое избыточное количество ионов H+ или OH–, сообщающие раствору кислотные или щелочные свойства. Гидролиз возможен в трех случаях:






