Основи хімічної термодинаміки
Хімічна термодинаміка – це розділ фізичної хімії, що вивчає перетворення енергії в хімічних процесах та енергетичні характеристики різних речовин.
Основні поняття хімічної термодинаміки:
· термодинамічна система;
· фаза;
· стан системи;
· параметри стану системи;
· термодинамічний процес.
Термодинамічна система – будь-яке тіло чи сукупність тіл, що знаходяться у взаємодії і фактично або уявно виділені з навколишнього середовища. Вони здатні обмінюватися між собою та з іншими тілами енергією й речовиною.

 | |||||
| |||||
| |||||
|

|
|
Сукупність всіх фізичних та хімічних властивостей системи називають станом системи. Стан системи характеризують термодинамічними параметрами.
Інтенсивні властивості – це властивості, які не залежать від маси і які вирівнюються при контакті систем (температура, тиск, молярні теплоємності, хімічний потенціал).
Екстенсивні – це властивості системи, які залежать від маси (об’єм, маса, теплоємність, внутрішня енергія, ентальпія, ентропія, термодинамічні потенціали). Екстенсивна властивість системи в цілому дорівнює сумі відповідних екстенсивних властивостей складових частин, що входять до даної системи.
Основні параметри стану – це параметри, які піддаються безпосередньому виміру:
Ø об’єм ( );
);
Ø тиск (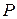 );
);
Ø температура (  );
);
Ø концентрація (С).
Функції стану – це параметри стану, які не піддаються безпосередньому виміру (внутрішня енергія, ентальпія, ентропія, термодинамічні потенціали).
Всі процеси, що зустрічаються у природі, можна поділити на: самодовільні (природні) та несамодовільні.). Несамодовільні процеси потребують витрат енергії (наприклад, розділення суміші газів на складові компоненти).
|
|
|

Види енергій
Внутрішня енергія ( ) –кількісна характеристика, яка характеризує загальний запас всіх видів енергії: поступального, обертального руху молекул, коливального руху атомів у молекулах, енергії міжмолекулярної взаємодії, внутрішньомолекулярної або хімічної енергії, енергії електронного збудження, внутрішньоядерної енергії тощо.
) –кількісна характеристика, яка характеризує загальний запас всіх видів енергії: поступального, обертального руху молекул, коливального руху атомів у молекулах, енергії міжмолекулярної взаємодії, внутрішньомолекулярної або хімічної енергії, енергії електронного збудження, внутрішньоядерної енергії тощо.
Uабс виміряти неможливо, але можна визначити її зміну:  .
.
 не залежить від того, як відбувається процес, а залежить від початкового та кінцевого станів системи.
не залежить від того, як відбувається процес, а залежить від початкового та кінцевого станів системи.
Макроенергія системи – це сума кінетичної та потенціальної енергій.
Загальна енергія системи – це кінетична, потенціальна та внутрішня енергії разом.
Ентальпія(Н) – це повний енергетичний запас системи, якщо Р = const.
|
|
 :
: 
.
Перший закон термодинаміки
Він має декілька визначень, пов’язаних між собою:
· Якщо система не обмінюється енергією з навколишнім середовищем (ізольована система), то її внутрішня енергія залишається сталою величиною. Це положення відоме як закон збереження енергії.
· Неможливо створити вічний двигун першого роду, тобто машину, що створює роботу без витрати енергії.
· Енергія не зникає безслідно й не виникає з нічого, перехід її з одного виду на інший відбувається в строго еквівалентних співвідношеннях.
· Теплота(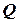 ), одержана із зовнішнього середовища, перетворюється в роботу (
), одержана із зовнішнього середовища, перетворюється в роботу ( ), створену системою, і викликає приріст внутрішньої енергії системи (
), створену системою, і викликає приріст внутрішньої енергії системи ( ):
):
|
.
Залежно від того, які параметри системи будуть сталими, перший закон термодинаміки матиме різний вигляд.
При  (ізотермічний процес) DU = 0. Уся теплота цілком переходить в роботу розширення:
(ізотермічний процес) DU = 0. Уся теплота цілком переходить в роботу розширення:
|
.
При  (ізохорний процес і) об’єм системи сталий, тому Арозширення = 0. Уся теплота витрачається на збільшення внутрішньої енергії системи:
(ізохорний процес і) об’єм системи сталий, тому Арозширення = 0. Уся теплота витрачається на збільшення внутрішньої енергії системи:
|
.
При  (ізобарний процес) кількість теплоти є мірою зміни ентальпії:
(ізобарний процес) кількість теплоти є мірою зміни ентальпії:
|
.