Мерой окислительно-восстановительной способности веществ служат окислительно-восстановительные потенциалы. Рассмотрим механизм возникновения потенциала. При погружении химически активного металла (Zn, Al) в раствор его соли, например Zn в раствор ZnSO4, происходят дополнительное растворение металла в результате процесса окисления, образование пары, двойного электрического слоя на поверхности металла и возникновение потенциала пары Zn2+/Zn°.
Металл, погруженный в раствор своей соли, например цинк в растворе сульфата цинка, называют электродом первого рода. Это двухфазный электрод, который заряжается отрицательно. Потенциал образуется в результате реакции окисления (рис. 5.1).

Рис. 5.1. Окисление цинка
Zn (т) + mH2O ↔ Zn2+ (р-р)×mH2O + 2ē
При погружении в раствор своей соли малоактивных металлов (Cu) наблюдается противоположный процесс. На границе металла с раствором соли происходит осаждение металла в результате процесса восстановления иона, обладающего высокой акцепторной способностью к электрону, что обусловлено высоким зарядом ядра и малым радиусом иона. Электрод заряжается положительно, в приэлектродном пространстве избыточные анионы соли формируют второй слой, возникает электродный потенциал пары Cu2+/Cu°. Потенциал образуется в результате процесса восстановления (рис. 5.2). Механизм, величина и знак электродного потенциала определяются строением атомов участников электродного процесса.
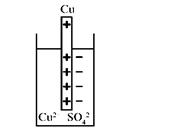
Рис. 5.2. Восстановление меди
Cu2+(р-р) ×mH2O + 2ē ↔ Cu(т) + mH2O
Итак, потенциал, который возникает на границе раздела металла с раствором в результате окислительного и восстановительного процессов, протекающих с участием металла (электрода) и образованием двойного электрического слоя называют электродным потенциалом.
Если отводить электроны с цинковой пластины на медную, то равновесие на пластинках нарушается. Для этого соединим цинковую и медную пластины, погруженные в растворы их солей, металлическим проводником, приэлектродные растворы - электролитным мостиком (трубка с раствором K2SO4), чтобы замкнуть цепь. На цинковом электроде протекает полуреакция окисления: Zn0(т) - 2ē → Zn2+(р-р), а на медном - полуреакция восстановления: Cu2+(р-р) + 2ē → Cu0(т)
Электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
Zn0(т) + Cu2+(р-р) → Zn2+(р-р) + Cu0(т)
В-ль ок-ль
Окислительно-восстановительные потенциалы пары зависят от природы участников электродного процесса и соотношения равновесных концентраций окисленной и восстановленной форм участников электродного процесса в растворе, температуры раствора и описываются уравнением Нернста.
Количественной характеристикой окислительно-восстановительной системы является редокс-потенциал, возникающий на границе раздела фаз платина - водный раствор. Величина потенциала в единицах СИ измеряется в вольтах (В) и рассчитывается по уравнению Нернста-Петерса:
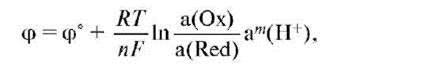
где а(Oх) и a(Red) - активность окисленной и восстановленной форм соответственно; R - универсальная газовая постоянная; Т - термодинамическая температура, К; F - постоянная Фарадея (96500 Кл/моль); n - число электронов, принимающих участие в элементарном редокс-процессе; а - активность ионов гидроксония; m - стехиометрический коэффициент перед ионом водорода в полуреакции. Величина φ° - стандартный редокс-потенциал, т.е. потенциал, измеренный при условиях а(Oх) = a(Red) = a(H+) = 1 и данной температуре.
Стандартный потенциал системы 2Н+/Н2 принят равным 0 В. Стандартные потенциалы являются справочными величинами, табулируются при температуре 298К. Сильнокислая среда не характерна для биологических систем, поэтому для характеристики процессов, протекающих в живых системах, чаще используют формальный потенциал, определяемый при условии а(Oх) = a(Red), pH 7,4 и температуре 310К (физиологический уровень). При записи потенциала пара указывается в виде дроби, причем окислитель записывается в числителе, а восстановитель в знаменателе.
Для 25°С (298К) после подстановки постоянных величин (R = 8,31 Дж/моль×град; F = 96500 Кл/моль) уравнение Нернста принимает следующий вид:

где φ°- стандартный окислительно-восстановительный потенциал пары, В; Со.ф. и Св.ф. - произведение равновесных концентраций окисленной и восстановленной форм соответственно; х и у - стехиометрические коэффициенты в уравнении полуреакций.
Редокс-системы делят на два типа:
1. в системе осуществляется только перенос электронов: Fe3++ē = Fe2+, Sn2+ - 2ē = Sn4+. Это изолированное окислительно-восстановительное равновесие;
2. системы, когда перенос электронов дополняется переносом протонов, т.е. наблюдается совмещенное равновесие разных типов: протолитическое (кислотно-основное) и окислительно-восстановительное с возможной конкуренцией двух частиц протонов и электронов. В биологических системах важные редокс-системы относятся к этому типу.
Примером системы второго типа является процесс утилизации перекиси водорода в организме: Н2О2 + 2Н+ + 2ē ↔ 2Н2О, а также восстановление в кислой среде многих окислителей, содержащих кислород: CrО42-, Cr2О72-, MnО4-. Например, MnО4- + 8Н+ + 5ē = = Mn2+ + 4Н2О. В данной полуреакции участвуют электроны и протоны.
Итак, окислительно-восстановительный потенциал (ОВП) – это потенциал системы, в которой активности окислительной и восстановительной форм данного вещества равны единице. ОВП измеряется с помощью окислительно-восстановительных электродов в сочетании со стандартными электродами сравнения.
В каждой окислительно-восстановительной реакции есть своя редокс-пара – эта пара имеет вещество в окисленной и восстановленной форме (Fe+3/Fe+2).
Количественной мерой активности редокс-пары является величина ее ОВП.
ОВПпары>>>окислитель
ОВПпары<<<восстановитель
ОВП зависит от:
· Природы редокс-пары,
· Концентрации
· Температуры






