Лабораторна робота 5
Контроль якості води. Визначення твердості води
господарсько-питного призначення
5.1 Мета роботи. Вивчити основні санітарно-гігієнічні вимоги до якості води та експериментально визначити твердість води, до та після іонітної очистки.
5.2 Короткі теоретичні відомості
Вода широко використовується в техніці: в хімічних виробництвах як розчинник і реагент, для промивання різноманітних речовин, для парових котлів, для охолодження різноманітних агрегатів і т.д.
Одним з основних показників якості води, важливим для багатьох водокористувачів (промисловість, сільське господарство, побут і т.і.), є мінералізація води. Суттєвий вплив на властивості води мають розчинені в ній домішки (табл.. 5.1). Так, вода морів і океанів непридатна для поливу грунту (вода вважається придатною для зрошення, якщо кількість розчинених в ній солей не перевищує 1000 мг/л), для пиття і для багатьох технічних цілей, так як в ній вміщується велика кількість солей. Загальна солоність, наприклад, морської води складає близько 3.5%. З них лише два компоненти (хлориди та натрій) присутні в кількості більше 1%, концентрація ж двох інших: сульфатів та магнію складають біля 0.1%, а таких чотирьох компонентів, як кальцій, гідрокарбонат, калій та бром, складають близько 0.001%. Інші елементи присутні в морській воді в дуже малих концентраціях, для багатьох з них вони нижче межі виявлення. Прісна річна та артезіанська вода також має різні домішки, але в значно менших кількостях. Ці домішки дуже необхідні для життя людини, тварин та рослин, але часто є дуже шкідливими при використанні води в техніці. Так, вміст у воді солей марганцю навіть у малих дозах робить її непридатною для використання у виробництві волокон, так як марганець окисляється киснем з повітря і випадає у вигляді діоксиду, фарбуючи волокна в бурий колір. Для парових котлів особливо шкідливими домішками є солі кальцію та магнію, а також кремнієва кислота. Ці домішки при високій температурі утворюють осад на стінках котла (накип), що погано проводить тепло, тому відбувається місцевий перегрів котла, що може привести до вибуху. Ці ж речовини осідають на внутрішніх стінках труб в системах водяного охолодження, погіршують теплообмін та виводять систему з ладу. В залежності від твердості води з певною інтенсивністю проходять процеси корозії енергетичного обладнання.
Присутність солей кальцію та магнію у воді визначає її твердість. В природних умовах утворення гідрокарбонатів проходить при взаємодії вугільної кислоти з вапняком, доломітом, згідно реакціям:
CaCО3 + CО2 + H2O ↔ Ca(HCO3)2 (5.1)
CaCО3 + MgCO3 + 2H2O + 2CO2 ↔ Ca(HCO3)2 + Mg(HCO3)2 (5.2)
Розрізняють карбонатну твердість (Тк), яка зумовлюється вмістом гідрокарбонатів кальцію та магнію; некарбонатну твердість (Тнк), яка зумовлюється вмістом хлоридів, сульфатів Са, Mg.
Загальна твердість (Тзаг) – визначається загальним вмістом солей твердості:
Тзаг = Тк + Тнк (5.3)
При тривалому кипінні твердість води зменшується за рахунок видалення карбонатної твердості:
Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O (5.4)
Mg(HCO3)2 ® MgCO3¯ + CO2 + H2O (5.5)
2Mg(HCO3)2 ® (MgOH)2CO3 + 3CO2 + H2O (5.6)
Кип’ятінням не можливо видалити всю карбонатну твердість (розчинність СаСО3 – 0.01 г/л, (MgOH)2CO3 – 0.04 г/л), тому іноді використовують термін тимчасова твердість, розуміючи під цим концентрацію солей Ca(HCO3)2 та Mg(HCO3)2, що видаляються з води після кип’ятіння її протягом двох годин. Твердість, що залишилася після кип’ятіння води називається постійною чи залишковою твердістю.
Розрізняють кальцієву твердість води, зумовлену присутністю кальцієвих солей та магнієву твердість, що пов'язана з присутністю магнієвих солей. Сумарна кальцієва та магнієва твердість називається загальною твердістю.
Твердість води виражається в ммоль-екв/дм3 (моль/м3), раніше – мг-екв/л. Таким чином, 20.04мг кальцію Са2+ зумовлюють 1 мг-екв/л кальцієвої твердості; 12.16 мг магнія Mg2+ - 1 мг-екв/л магнієвої твердості. Загальну твердість води визначають по формулі:
 ,ммоль-екв./л (5.7)
,ммоль-екв./л (5.7)
де Са2+, Mg2+ - вміст кальцію та магнію в одному літрі води в мг.
Твердість природної води залежить від джерела та пори року. Під час весняних паводків твердість води поверхневих басейнів зменшується, а в зимній період зростає. В зв'язку з різноманіттю води в природі та природно-антропогенним характером формування її якості класифікація вод має велике значення.
В основу ранніх класифікацій вод, що розроблялися В.І.Вернадським, О.А.Алекіним, було положено загальне солевміщення (ступінь мінералізації) та вміст іонів: 
В таблицях 5.2- 5.6 та на рисунку 5.1 наведені різноманітні класифікації вод, які цікаві тим, що дозволяють орієнтовно оцінити можливість та область використання тих чи інших методів очистки, в тому числі іонообмінного та електролізу.
Для пом'якшення води використовують два методи: осадження та іонний обмін.
Для осадження кальцію та магнію найбільш широко використовують соду, вапно, фосфат натрію та ін. Вапно взаємодіє з солями магнію та осаджує магній у вигляді гідрооксиду:
MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2 (5.8)
Сода взаємодіє з солями кальцію, утворюючи важкорозчинний карбонат кальцію:
CaSO4 + Na2CO3 = CaCO3¯ + Na2SO4 (5.9)
Для видалення карбонатної твердості методом осадження використовують вапняковий, натронний та содовий методи.
Вапняковий метод використовують при високій карбонатній твердості (Тк), малій некарбонатній (Тнк):
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O (5.10)
Mg(HCO3)2 + 2Ca(OH)2 = 2CaCO3¯ + Mg(OH)2¯ + 2H2O (5.11)
Підвищення температури, створення надлишкової кількості Са(ОН)2, перемішування – покращують ефект зниження Тк, а також зниження загального солевмісту та вільного СО2.
Натронний метод.
Ca(HCO3)2 + 2NaOH = CaCO3¯ + Na2CO3 + 2H2O (5.12)
Mg(HCO3)2 + 4NaOH = Mg(OH)2¯ + 2Na2CO3 + 2H2O (5.13)
Содовий метод.
Ca(HCO3)2 + Na2СO3 = CaCO3¯ + 2NaНCO3 (5.14)
Mg(HCO3)2 + Na2СO3 = MgСO3¯ + 2NaНCO3 (5.15)
На практиці часто використовують вапняково-содовий метод (Тк>>Тнк). Максимальна ступінь пом'якшення вапняково-содовим методом 0,3...0,5 ммоль-екв./л.
Для видалення некарбонатної твердості використовують содовий та фосфатний методи.
Содовий метод.
CaSO4 + Na2CO3 = CaCO3¯ + Na2SO4 (5.16)
MgSO4 + Na2CO3 = MgCO3¯ + Na2SO4 (5.17)
Фосфатний метод.
3CaSO4 + 2Na3РO4 = Ca3(РO4)2¯ + 3Na2SO4 (5.18)
3MgSO4 + 2Na3РO4 = Mg3(РO4)2¯ + 3Na2SO4 (5.19)
При фосфатному методі пом'якшення води максимальна ступінь пом'якшення 0.05 ммоль/л.
Останнім часом для очистки води, зниження твердості води стали широко використовують іоннообмінний метод
Іоніти - це неплавкі та нерозчинні (чи малорозчинні) речовини, які обмежено набухають у воді. У своїй структурі мають функціональні групи кислотного та основного характеру, що здатні обмінюватись на іони речовин, розчинених в воді. Частіше іоніти представляють собою тверді високомолекулярні полікислоти і поліоснови чи їх солі. В залежності від характера функціональних груп іоніти можуть обмінюватися катіонами (катіоніти) чи аніонами (аніоніти). (Див. таблиці 5.6–5.8, рис. 5.1, де представлені марки іонітів, приведені дані по регенерації відпрацьованих іонітів та схема катіонітового фільтру).
Механізм іонітної очистки.
Тверда вода пропускається через шар катіоніта. При цьому проходить, наприклад, такий процес:
CaSO4 + 2HR ↔ CaR2 + H2SO4 (5.20)
Ca2+ + 2HR ↔ CaR2 + 2H+ (5.21)
де R – залишок молекули катіоніта (смоли, що містять карбоксильні групи – СООН, або сульфогрупи – SO3H та ін.). для водоочищення використовують не тільки органічні, а й неорганічні катіоніти – цеоліти (мінерали) чи пермутити (штучно отримані сполуки), що відповідають Na-катіоніту – Na2O × Al2O3 × 3SiO2 × nH2O і звичайно позначаються Na2R (є й Н+-катіоніти – H2R).
При проходженні води через катіоніт в Н+-формі іони кальцію та магнію обмінюються на іони водню і вода стає кислою. Таку воду не можна використовувати для технічних цілей, бо вона буде викликати корозію труб, руйнувати арматуру і т.д. Тому далі цю воду пропускають через аніоніт в ОН--формі:
H2SO4 + 2ROH Û (R)2SO4 + 2H2O (5.22)
Після такої послідовної очистки воду можна використовувати для різних цілей в техніці.
Для парових котлів твердість води повинна бути £0.017 моль/м3 (H2SiO3 £ 30; Fe £ 100, O2 £ 30; мастила £ 0.5 мг/л).
Наприклад, для промислової електроніки використовують демінералізовану воду, яка за якістю перевищує бідистилят (воду подвійної перегонки). Вміст солей Са2+ та Mg2+ - 10-1...10-2 мг/л. Вимоги до якості енергетичної води наведені в таблиці 5.9
Експериментальна частина
5.3.1 Визначення загальної твердості води
Хід аналізу. Пробу води (5 мл – піпеткою) розбавляють дистильованою водою в конічній колбі (250 мл) приблизно до 100 мл; доливають 5 мл аміачного буферного розчину (суміш NH4Cl та NH4OH) та додають декілька крапель (»10 крапель) індикатору – еріохрому чорного Т до утворення винно-червоного кольору з фіолетовим відтінком і титрують (при енергійному перемішуванні) розчином трилону Б (з бюретки) до переходу забарвлення в синє з зеленуватим відтінком.
.
5.3.2 Обробка результатів
Розрахунок значення загальної твердості здійснюють за формулою:
Тв = (Nтр × Vтр × 1000)/ 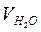 , моль-екв./м3 (ммоль-екв/л) (5.23)
, моль-екв./м3 (ммоль-екв/л) (5.23)
Тв1=(0.1*0.7*1000)/5=14 моль-еквівалент/м^3
Тв2==(0.1*0.1*1000)/5=2 моль-еквів/ м^3
де Nтр – нормальність трилона Б; Vтр – кількість трилона Б, використана на титрування, мл; 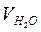 - об'єм проби води, взятої для визначення, мл.
- об'єм проби води, взятої для визначення, мл.
5.4 Висновок: Експериментально визначено загальну твердість води. Вона складає 14 моль-еквів./м^3-до очистки;2моль-еквів./м^3.Очищену воду можна використовувати для живлення барабанних котлів з P=10МПа.






