К этой группе относятся реакции между фенилгидразином и аминоальдегидами с защищенной аминогруппой. Защита аминогруппы позволяет избежать нуклеофильной атаки азота по карбонильной группе и предотвращает циклизацию, что в свою очередь позволяет использовать такие соединения для генерации фенилгидразона γ-аминобутаналя. Примерами таких синтезов являеются перегруппировки фталоилзамещенных гидразонов 30 в соответствующие триптамины 31 [14]
Схема 11.

Реакция проходит с хорошими выходами 81-91%. Снятие защитной группы гидразин-гидратом и обработка HCl приводили к образованию гидрохлоридов триптаминов 32
К этой группе также относится множество модификаций синтеза индолов по Фишеру, в которых в реакцию с фенилгидразоном вступают карбонильные соединения, не содержащие аминогруппу. Продуктом этих реакций являются индолы с этиленовым фрагментом, которые вдальнейшем могут быть превращены в триптамины. В литературе можно найти примеры реакций, где в качестве предшественника аминоэтильной группы использовалась хлорэтильная группа. (Схема 12) Так, при проведении реакции нитрофенилгидразина 33 с хлорбутаналем 34 выход 2-хлорэтильного производного 35 — предшественника триптамина 36 — оказался низким, что было обусловлено высокой реакционной способностью хлорида и низкой реакционной способностью нитрофенилгидразонов в условиях реакции Фишера [15].
Схема 12.

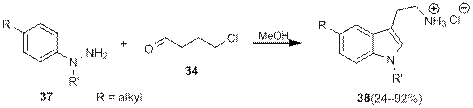
Тем не менее Грандберг и Боброва показали, что при использовании в описанной реакции алкиларилгидразинов 37, алкилирование незамещенного атома азота «галогенидным хвостом» с образованием N -(ариламино)пирролина происходит раньше перегруппировки Фишера, в результате чего образование триптамина 38 происходит в одну реакционную стадию, причем во многих случаях с очень высокими выходами (схема 13).
Схема 13.
Приемлемый метод синтеза триптаминов по Фишеру через предшественники аминогруппы был разработан недавно Баскараном и Кенигом [16], которые синтезировали индольный цикл путем взаимодействия гидроксибутаналя 39 с п -метоксифенилгидразином 40 в расплаве эвтектической смеси винной кислоты с диметилмочевиной. Полученный гидроксиэтилиндол 41 далее был превращен в 5 стадий в мелатонин 42 с суммарным выходом 80%. (Схема 14)
Схема 14.

Во всех методах синтеза это группы представляется возможным введение заместителя как в α- так и в β-положения боковой цепи, так как производные исходных бутаналей доступны, но в литературе найдено небольшое количество примеров проведения данных реакций.






