Энтропия, будучи функцией состояния тела, может служить таким же параметром состояния тела как T,V,P. Энтропия S может быть выражена через любые из двух параметров P,V,T. Рассмотрим, как это делается. Это тем более интересно, поскольку S нельзя измерить на эксперименте.
Из термодинамического тождества (1.39) имеем
 ,
,

 .
.
Из любых из четырёх величин T,S,P и V, входящих в это уравнение, можно выбрать в качестве независимых переменных две, через которые можно выразить остальные. Выберем в качестве независимых переменных T и Р, то есть состояние системы изменяется в результате изменения T и Р. Вычислим изменение dS. Поскольку энтропия является функцией состояния, ее полный дифференциал dS можно представить в виде
 . (1.40)
. (1.40)
Учитывая, что,  где СР –теплоемкость при постоянном давлении, выражение (1.40) имеет вид
где СР –теплоемкость при постоянном давлении, выражение (1.40) имеет вид
 . (1.41)
. (1.41)
Для расчета производной  воспользуемся методом термодинамических потенциалов. Одним из потенциалов термодинамики является внутренняя энергия U, дифференциал которой равен
воспользуемся методом термодинамических потенциалов. Одним из потенциалов термодинамики является внутренняя энергия U, дифференциал которой равен
dU=TdS-PdV (1.42)
Введем еще потенциалы:
H= U+PV - энтальпия или теплосодержание;
F=U-TS - cвободная энергия;
Ф=U-TS+PV - большой термодинамический потенциал.
Дифференциалы этих потенциалов с учетом (1.42) имеют вид:
dH=TdS+VdP
dF=-SdT-PdV
dФ=-SdT+VdP.
Поскольку все термодинамические потенциалы являются функциями состояния и имеют полные дифференциалы, для них справедливы соотношения
 , (1.43)
, (1.43)
 , (1.44)
, (1.44)
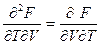 , (1.45)
, (1.45)
 . (1.46)
. (1.46)
Из (1.43) с учетом выражения (1.42) для dU имеем
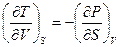 . (1.47)
. (1.47)
Из (1.44) с учетом выражения для dH получим
 . (1.48)
. (1.48)
Из (1.45) с учетом выражения для dF получим
 . (1.49)
. (1.49)
Из (1.46) и выражения для dФ имеем
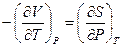 . (1.50)
. (1.50)
Выражения (1.47)-(1.50) называют соотношениями Максвелла.
Формулу (1.41), используя соотношение (1.47), перепишем в виде
 . (1.51)
. (1.51)
Считая, что энтропия является функцией температуры и объема, используя соотношение (1.49), можно записать следующее выражение для дифференциала энтропии
 .
.
Поскольку
 (1.52)
(1.52)
Используя (1.51) и (1.52) можно вычислить энтропию для данной массы вещества при данных значениях объема V и температуры Т, которую обозначим S(T,V), или при данных значениях давления Р и температуры Т S(P,T), если известны значения энтропии S(T0,V0) и S(T0,P0) при каких-нибудь других значениях этих параметров V0 и Т0 или Р0 и Т0..
 Пусть система переходит из состояния 1 в состояние 2 по пути, указанной на рис. 4а. Поскольку энтропия является функцией состояния и ее изменение не зависит от формы пути, а определяется конечным и начальным состоянием,
Пусть система переходит из состояния 1 в состояние 2 по пути, указанной на рис. 4а. Поскольку энтропия является функцией состояния и ее изменение не зависит от формы пути, а определяется конечным и начальным состоянием, 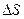 по пути 12 совпадет со значением изменения энтропии
по пути 12 совпадет со значением изменения энтропии 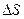 по пути 1а2, т.е.
по пути 1а2, т.е.
 .
.
 .
.
В частности для 1 моля идеального газа
 ,
,
а

 так как
так как 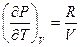 .
.
Таким образом, для идеального газа
 .
.
Это значит, что энтропия идеального газа возрастает с увеличением объема и температуры.






