Тривалість виконання: 2 год.
Теоретична частина
Ароматичними амінами називаються сполуки, в молекулах яких міститься аміногрупа (-NH2, -NHR або –NR2), сполучена з С-атомом ароматичного ядра. Найпростішим первинним ароматичним аміном є анілін C6H5NH2, вторинним – дифеніламін (C6H5)2NH, третинним – трифеніламін (С6H5)3N. Існують також жирно-ароматичні аміни, до складу яких входять не тільки ароматичні, а й аліфатичні радикали:
N-метиланілін – C6H5-NH-CH3, N,N-диметиланілін - C6H5-N(CH3)2. Відомі аміни з аміногрупою в бічному ланцюгу – бензиламін C6H5CH2-NH2,
Хімічні властивості ароматичних амінів визначаються аміногрупою і сполученим з нею ароматичним ядром. Аміногрупа проявляє негативний індукційнй ефект (– І) та протилежний по дії позитивний мезомерний ефект (+ М), який значно сильніший від її – І ефекту. Вільні електрони атома нітрогену аміногрупи взаємодіють з π-електронами бензольного ядра (явище ρ,π-спряження).У зв’язку зі спряженням електронна густина на атомі нітрогену в молекулах ароматичних амінів зменшується. Внаслідок цього зменшується здатність амінного нітрогену приєднувати протон і основні властивості ароматичних амінів значно послаблюються порівняно з основними властивостями амоніаку. Разом з тим, за рахунок сильного + М -ефекту аміногрупи, електронна густина підвищується в о -і п -положеннях бензольного ядра і збільшується активність цих сполук в реакціях електрофільного заміщення. Приєднання протона до аміногрупи (утворення C6H5-NH3+) перетворює її з о -, п -орієнтанта в досить сильний м -орієнтант, оскільки зникає в молекулі ρ,π-спряження, тобто + М – ефект не проявляється, залишається лише сильний – І -ефект.
.
Експериментальна частина
Дослід 1. Взаємодія аніліну з мінеральними кислотами
У дві пробірки наливають по 1 мл аніліну. В одну додають кілька крапель 10%-ої соляної кислоту, в іншу– 10%-ої сульфатної кислоти.
Спостереження:
Рівняння реакцій:
Дослід 2. Взаємодія аніліну з бромною водою
До 1 мл водного розчину аніліну додають краплями бромну воду.
Спостереження:
Рівняння реакції:
Дослід 3. Взаємодія з хлорним вапном
До краплі розчину солянокислого аніліну (дослід 1) на предметному склі додають краплю насиченого розчину хлорного вапна – CaOCl2.
Спостереження:
Дослід 4. Взаємодія аніліну з лігніном
Краплю розчину солянокислого аніліну (дослід 1) наносять на клаптики газетного і фільтровального паперу.
Спостереження:
Висновок:
Техніка безпеки
1. Досліди проводять у витяжній шафі.
2. При виконанні дослідів 2 і 3 слідкувати за тим, щоб бромна вода або хлорне вапно не потрапили на шкіру. Берегти очі! При попаданні на шкіру хлорного вапна промити уражене місце водою та нейтралізувати 1%-им розчином оцтової кислоти, бромну воду змити і нейтралізувати 1%-им розчином гідрокарбонату натрію.
3. При попаданні кислот на шкіру промити уражене місце водою та нейтралізувати 1%-им розчином гідрокарбонату натрію.
Контрольні запитання та завдання
1. Наведіть методи добування ароматичних амінів.
2. Порівняйте основні властивості амоніаку, етиламіну та аніліну.
3. За допомогою яких хімічних реакцій можна розрізнити: а) анілін і циклогексиламін; б) N-метиланілін і о -толуїдін; в) анілін і ацетаналід.
4. Запропонуйте хімічні методи для розділення таких сумішей: а) анілін і гексан;
б) анілін і анізол; в) о -нітроанілін і сульфанілова кислота.
5. Поясніть, чи однакову активність виявляють анілін і бензол у реакціях бромування, нітрування, сульфування.
Завдання для самостійної роботи
Здійсніть перетворення:
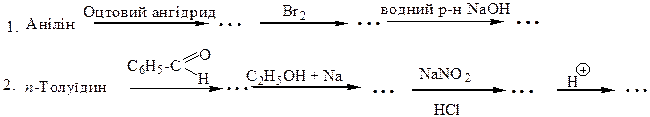
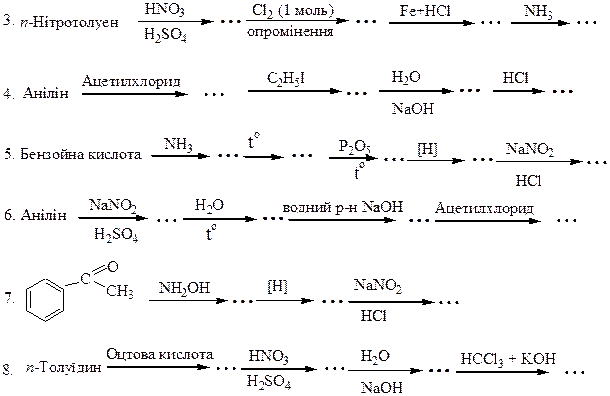
Перетворити в декілька стадій:
1. Бензен  сульфанілова кислота.
сульфанілова кислота.
2. Анілін  2,6-диброманілін.
2,6-диброманілін.
3. п - Толуїдин  п -ацетамінобензойна кислота.
п -ацетамінобензойна кислота.
4. Бензен  п - нітроанілін.
п - нітроанілін.
5. Анілін  п -амінобензолсульфамід.
п -амінобензолсульфамід.
6. Бензен  м -броманілін.
м -броманілін.
7. Толуен  2-аміно-3-бромотолуен.
2-аміно-3-бромотолуен.
8. Анілін  п -нітрозо-N-етиланілін.
п -нітрозо-N-етиланілін.
9. Анілін  хлорид о -хлорофеніламонію.
хлорид о -хлорофеніламонію.
10. Бензен  о -нітроанілін.
о -нітроанілін.
11. Толуен  м -броманілін.
м -броманілін.
12. Толуен  4-аміно-3-нітротолуен.
4-аміно-3-нітротолуен.
Виконати завдання: [2], № 6. 4. 3, 5, 6, 8,16, 21, 25 26, 30, 33, 34.
Лабораторна робота 5
Тема: Діазо- і азосполуки
Мета роботи: Вивчити методи добування і властивості діазо- і азосполук, провести відповідні досліди.
Тривалість виконання: 2 год.
Теоретична частина
Ароматичними діазосполуками називають органічні речовини, молекули яких містять діазогрупу. Найважливішими з ароматичних діазосполук є солі діазонію, які мають загальну формулу [Ar-N = N]+X- , де X- -аніони Cl-, Br-, NO3, HSO4-, BF4- тощо. Ароматичні солі діазонію добувають взаємодією первинних ароматичних амінів з нітритною кислотою в розчині мінеральної кислоти. Реакцію утворення діазосполук з амінів називають діазотуванням, а нестійку нітритну кислоту генерують взаємодією нітриту натрію з мінеральною кислотою, переважно соляною або сульфатною:
Ar-NH2 + NaNO2 + 2HX  [Ar-N = N]+ X- +NaX +H2O
[Ar-N = N]+ X- +NaX +H2O
0-5оС
Солі діазонію за певних умов реагують з ароматичними сполуками, молекули яких містять сильну електронодонорну групу –OH, -NR2,- NHR, -NH2. Як діазоскладові в цій реакції використовують діазосолі, найчастіше добуті діазотуванням нітроаніліну, сульфанілової і антранілової кислот тощо, в бензольному ядрі яких містяться електроноакцепторні замісники. Азоскладовими можуть бути аміно- і гідроксипохідні ароматичного ряду, бензольне ядро яких має підвищену електронну густину. Ця реакція, яку називають азосполученням, відбувається за схемою електрофільного заміщення з утворенням азосполук, які містять азогрупу –Ar-N=N-Ar′. Бензен, гомологи бензену, галогено-, сульфо-, нітропохідні ароматичного ряду, ароматичні карбонові кислоти в реакцію азосполучення не вступають. Азосполуки мають забарвлення, яке пов,язане з їх здатністю поглинати у видимій частині спектра деякі промені з певними довжинами хвиль. При цьому промені спектра, які не поглинаються, є додатковими і спримаються як видимі, тому речовина стає забарвленою. Азосполуки, молекули яких можуть сполучатися з волокнами і фарбувати їх, називаються азобарвниками.
Експериментальна частина
Дослід 1. Реакція діазотування
В колбі готують розчин солянокислого аніліну, використовуючи 1-3 мл аніліну та 10 мл 10%-ої соляної кислоти. Розчин охолоджують льодом до 0-5оС і, не виймаючи колби з льоду, приливають краплями при перемішуванні 1,5-2 мл 10%-го розчину нітриту натрію. Кінець реакції визначають посинінням йодокрохмального папірця, на який наносять скляною паличкою краплю реакційного розчину.
Спостереження:
Рівняння реакції:
Дослід 2. Одержання фенолу з солі фенілдіазонію
В пробірку наливають 1 мл розчину фенілдіазоній хлориду, отриманого у попередньому досліді, і обережно підігрівають до початку виділення бульбашок азоту, звертають увагу на характерний запах фенолу.
Спостереження:
Рівняння реакції:
Дослід 3. Реакція азосполучення
У пробірку вносять 0,2 г β-нафтолу і додають 2-3 мл 10%-го розчину гідроксиду натрію, після розчинення додають1-2 мл охолодженого розчину фенілдіазоній хлориду, одержаного в досліді 1.
Спостереження:
Рівняння реакції:
Висновок:
Техніка безпеки
1. Досліди проводити у витяжній шафі.
2. При попаданні соляної кислоти на шкіру промивають уражене місце водою та нейтралізують її 1%-им розчином гідрокарбонату натрію, а якщо це розчин гідроксиду натрію, то його змивають водою та нейтралізують 1%-им розчином оцтової кислоти.
3. Перед початком нагрівання суміші у досліді 2, треба додати у пробірку шматочок порцеляни (центри пароутворення), а при нагріванні пробірку необхідно струшувати і направляти її отвір від себе і студентів.
Контрольні запитання та завдання
1. Наведіть механізм діазотування ароматичних амінів.
2. Які реакції відбуваються на папірці, просоченому крохмалем і йодидом калію?
3. Порівняйте вплив електроноакцепторних і електронодонорних замісників у бензольному ядрі ароматичних амінів на швидкість реакції діазотування.
4. До якого типу реакцій відноситься реакція азосполучення? Наведіть її механізм.
5. Що таке хромофорні групи? Як впливають на забарвлення азобарвників ауксохромні групи, наведіть їх.
Завдання для самостійної роботи
Здійсніть перетворення:
Fe + HCl NaNO2 + HCl H2O, to
1. п -Нітроанізол  …
…  …
…  …
…
O0C
HNO3 (NH4)2S NaNO2 + HCl KCl
2. Нітробензен  …
…  …
…  …
…  …
…
H2SO4 O0C Cu2Cl2
Оцтова кислота Br2 H2O HCl
3. п -Толуїдин  …
…  …
…  …
…  …
…
NaOH, to
Br2 NaNO2 + HCl KCN H2O
4. п -Толуїдин  …
…  …
…  …
…  …
…
O0C Cu2(CN)2 H+
H2SO4 NaNO2 + HCl N,N-диметиланілін
5. Анілін  …
…  …
…  …
…
to O0C
NaNO2 + HCl H2O NaOH Ацетилхлорид
6. м -Толуїдин  …
…  …
…  …
…  …
…
O0C to
NaNO2 + HCl Фенол
7. о -Толуїдин  …
…  …
…
O0C слабко лужне середовще
Перетворити в декілька стадій:
1. Анілін  п -нітробензойна кислота.
п -нітробензойна кислота.
2. Толуен  3-бромо-4-йодобензойна кислота.
3-бромо-4-йодобензойна кислота.
3. Бензен  м -хлоробензен.
м -хлоробензен.
4. Нітробензен  п -амінофенол.
п -амінофенол.
5. Бензен  2,2,-дихлороазобензен.
2,2,-дихлороазобензен.
6. Бензен  метилоранж.
метилоранж.
7. 3-Аміно-5-нітротолуен  м -нітротолуен.
м -нітротолуен.
8. Нітробензен  м -фторофенол.
м -фторофенол.
9. Толуен  п- фтороанілін.
п- фтороанілін.
10. Бензен  о -фторобромбензен.
о -фторобромбензен.
Виконати завдання:[2], № 6. 5. 2, 5-7, 12-13, 27-36; № 6. 6. 3, 8, 9, 13-15, 20-21
Лабораторна робота 6






