Мета роботи: Вивчити хімічні властивості фенолу та двоатомних фенолів, провести хімічні досліди, вивчити якісні реакції.
Тривалість виконання: 2 год.
Теоретична частина
Властивості фенолів пов’язані з наявністю в молекулі функціональної групи –ОН. На прикладі хімічних властивостей фенолу можна показати вплив бензольного ядра на властивості гідроксильної групи, зв’язаної з ним безпосередньо. У той час, як спирти проявляють слабко кислотні властивості (взаємодія з натрієм), феноли, як кислоти, сильніші, ніж спирти, але слабші, ніж карбонатна та карбонові кислоти. Кислотні властивості фенолів зумовлені спряженням неподіленої пари електронів атома кисню групи –ОН з π-електронами бензольного ядра. Наявність такого ефекту р–π–спряження, зменшує частковий негативний заряд на атомі кисню і, отже, полегшує відрив від нього протона з утворенням фенолят-йона.
Таким чином, феноли – це типові ОН-кислоти. Тому феноли взаємодіють не тільки з натрієм, але й, на відміну від спиртів, із сильними основами – лугами (дослід 2) утворюючи феноляти. Зі слабкими основами, так само як і карбонати лужних металів, феноли не взаємодіють. Феноли здатні утворювати феноляти не тільки з лужними металами, але й із солями важких металів (дослід 3).
Кислотність фенолів залежить від природи замісника в бензольному ядрі. Електроноакцепторні замісники збільшують кислотність, а електронодонорні – зменшують [1. с. 689-690].
У зв’язку з тим, що гідроксильна група є сильним орто- і пара-орієнтант електронодонорної дії, реакції єлектрофільного заміщення проходять відносно легко і не потребують жорстких умов [1. с. 695-702].
Хімічні властивості двоатомних фенолів подібні до одноатомних. Їх кислотність зростає порівняно з одноатомними, і вони утворюють солі зі сполуками деяких важких металів. Двоатомні феноли більш легко вступають у реакції електрофільного заміщення. При переході від одноатомних фенолів до триатомних, ароматичний характер фенолів зменшується [1. с. 707-708].
Експериментальна частина
Дослід 1. Розчинність фенолу у воді
У пробірку поміщають 0,5 г кристалічного фенолу і додають 2 мл води. При струшуванні фенол частково розчиняється. Після відстоювання утворюється два шари рідини. Нижній шар – розчин води у фенолі, верхній – розчин фенолу у воді. Обережно нагріваючи розчин, спостерігаємо, що фенол повністю розчиняється у воді. При охолодженні – рідина знову розшаровується [1, 2].
Спостереження:
Рівняння реакції:
Дослід 2. Доведення кислотного характеру фенолу
(одержання феноляту натрію)
Струшують вміст пробірки з попереднього досліду до утворення емульсії та додають краплями 10 %-ий розчин гідроксиду натрію. Що при цьому спостерігається? Коли до розчину утвореного у пробірці феноляту натрію додати мінеральну кислоту (НС1), то відбудеться виділення вільного фенолу.
Спостереження:
Рівняння реакції:
Дослід 3. Взаємодія фенолу з хлоридом заліза (ІІІ)
У пробірку наливають 2 мл розчину фенолу і додають 2-3 краплі 2 %-го розчину хлориду заліза (ІІІ). Якісна реакція на фенол.
Спостереження:
Рівняння реакції:
Дослід 4. Взаємодія фенолу з бромом
У пробірку наливають 0,5 мл розчину фенолу і, безперервно струшуючи пробірку, додають бромну воду. Якісна реакція на фенол.
Спостереження:
Рівняння реакції:
Дослід 5. Реакція утворення азобарвника
У пробірку наливають 0,5 мл розчину фенолу, додають до нього 0,3 мл 0,1 %-го розчину сульфанілової кислоти та 1 %-го розчину нітриту натрію. До утвореної суміші додають 1-2 мл 10 %-го розчину НС1 і через 1-3 хв. – кілька краплин 10 %-го розчину амоніаку.
Спостереження:
Рівняння реакції:
Дослід 6. Кольорова індофенолова проба
(реакція Лібермана)
У пробірку поміщають 0,2-0,3 г фенолу і додають 3-5 краплин концентрованої сульфатної кислоти і 5-6 крапель 15%-го розчину нітриту натрію. Вміст пробірки забарвлюється. Потім додають 10%-ий розчин гідроксиду натрію. При цьому утворюється натрієва сіль індофенолу, яка змінює забарвлення розчину. Спостерігають за зміною кольору.
Спостереження:
Рівняння реакції:
Дослід 7. Конденсація фенолу з формальдегідом
У дві пробірки наливають по 2 мл формаліну і додають по 0,5 г фенолу.
У одну пробірку як каталізатор додають розчин амоніаку, а у другу – соляну кислоту (по 3-5 крапель). Реакційні суміші нагрівають на водяній бані впродовж 5-10 хв. Потім суміш охолоджують.
Спостереження:
Рівняння реакції:
Дослід 8. Реакція срібного дзеркала
У чисту пробірку наливають 2 мл водного розчину лугу і, обережно нагріваючи, доводять до кипіння. Потім цей розчин виливають, у пробірку поміщають 2-3 мл 1 %-го розчину нітрату срібла (AgNO3) і додають по краплях 5 %-ий розчин амоніаку так, щоб осад, який утворився в пробірці, зник. До утвореного таким чином амонійного розчину гідроксиду срібла додають 1%-ий розчин гідрохінону. Суміш обережно підігрівають.
Спостереження:
Рівняння реакції:
Дослід 9. Реакція відновлення реактиву Фелінга
Готують реактив Фелінга. Для цього змішують рівні об’єми розчину сульфату міді (розчин І) та лужного розчину сегнетової солі (розчин ІІ).
У розчин, який стає яскраво-синього кольору, додають 1 %-ий розчин гідрохінону. Реакційну суміш нагрівають на водяній бані.
Спостереження:
Рівняння реакції:
Висновок:
Техніка безпеки
1. Досліди з фенолом проводити у витяжній шафі.
2. При попаданні розчину фенолу на шкіру, промити уражене місце водою, накласти ватний чи марлевий тампон, змочений гліцерином.
3. При попаданні розчину лугу на шкіру, промити уражене місце великою кількістю води та нейтралізувати 1 %-им розчином оцтової кислоти.
4. При попаданні кислоти на шкіру, уражене місце промити великою кількістю води та нейтралізувати 1 %-им розчином гідрокарбонату натрію.
5. При попаданні бромної води на шкіру, промити уражене місце розчином амоніаку.
6. Після проведення реакції срібного дзеркала (дослід 8), суміш вилити у спеціальний посуд. Пробірку здати лаборанту.
7. Після проведення усіх реакцій з фенолом, суміші вилити в спеціальний посуд.
Контрольні запитання та завдання
1. Яким чином можна довести кислотні властивості фенолів?
2. Напишіть схему взаємодії фенолу з гідроксидом натрію. Наведіть перерозподіл електронної густини в молекулі фенолу.
3. Що мається на увазі під поняттям “фенольний гідроксил”?
4. Якими реакціями можна довести наявність фенольного гідроксилу у молекулі сполуки?
5. Порівняйте реакційну здатність бензолу і фенолу в реакціях SЕ. Поясніть, чим зумовлена велика реакційна здатність бензольного ядра в молекулі фенолу?
6. Напишіть схему взаємодії фенолу з бромною водою.
7. Поясніть появу інтенсивного забарвлення під час взаємодії фенолу із сульфаніловою кислотою і нітритом натрію в солянокислому середовищі.
8. Напишіть механізм реакції SЕ для фенолу.
Завдання до самостійної роботи
Здійснити перетворення:
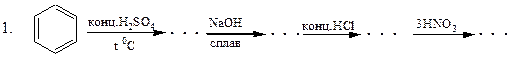
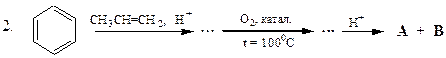
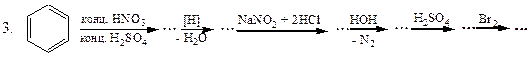
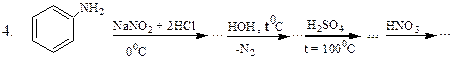
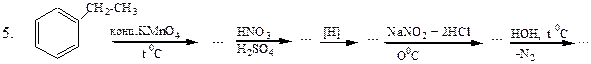
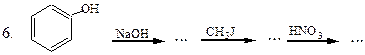
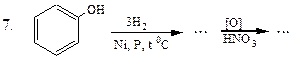
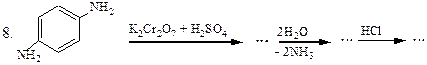
Перетворити в декілька стадій:
1. Бензен  о -нітрофенол.
о -нітрофенол.
2. Бензен  саліцилова кислота.
саліцилова кислота.
3. Анілін  2,4,6-трибромфенол.
2,4,6-трибромфенол.
4. Нітробензен  п -фенолсульфокислота.
п -фенолсульфокислота.
5. Бензен  2-бром-4-фенолсульфокислота.
2-бром-4-фенолсульфокислота.
6. Бензен  3-гідроксибензойна кислота.
3-гідроксибензойна кислота.
7. Нітробензен  м-фенолсульфокислота.
м-фенолсульфокислота.
8. Кумен  2,4,6-тринітрофенол.
2,4,6-тринітрофенол.
9. Бензен  новолачна смола.
новолачна смола.
10. Бензен  п -гідроксиацетофенон.
п -гідроксиацетофенон.
Виконати завдання: [2], № 3.1.6, 7, 9, 11, 16, 18, 22, 27, 29, 31, 35, 36, 37, 38, 41.
[3], № 977-982, 986- 988, 990.
Лабораторна робота 4
Тема: Ароматичні аміни






