ФГЗ және химия кафедрасы
СӨЖ
Тақырыбы: Органикалық қосылыстардың химиялық байланыс түрлері және олардың негізгі сипаттамасы. Бір, екі, үш хиральды орталығы бар молекулалардың стереоизомерлері.
Орындаған: Келдібек А.
Тобы: 203 «Б» ФК
Шымкент 2015 ж
ЖОСПАР
І. Кіріспе
ІІ. Негізгі бөлім
1. Органикалық қосылыстардың химиялық байланыс түрлері және олардың негізгі сипаттамасы.
2. Органикалық қосылыстардың кеңістіктегі құрылысы (стереоизомерия)
3. Органикалық заттардың кеңістіктегі құрылысы мен биологиялық белсенділігінің арасындағы байланыс.
ІІІ. Қорытынды
ІV. Пайдаланылған әдебиеттер
Кіріспе
Атомдар арасында химиялық байланыстың туындауына байланысты олар молекулаға бірігеді. Ядролардың арасындағы кеңістікте электрондық бұлт тығыздығының артуы ядроларды тартады, жақындатады және электрондардың потенциалдық энергиясын, бүтіндей барлық жүйенің энергиясын да төмендетеді.
Химиялық байланыс молекулалардың орбиталдар түзе жүретін екі немесе одан да көп атомдық орбиталдардың әрекеттесуі кезінде қарастырылады.
Ең қарапайым, жай жағдайда химиялық байланыс екі электронмен түзіледі, пайда болады немесе туындайды.
Құрылымдық изомерлер- құрамы бірдей, бірақ тізбектің немесе сақинаның құрылысы, қос немесе үш байланыстың болуы, функционалдық топтар мен радикалдар қүрылысының өзгешелігіне байланысты болатын изомерлер.
Стереоизомерлер- құрамы мен құрылысы бірдей, бірақ атомдардың кеңістіктегі орналасу айырмашылығы бар изомерлер.
Барлық стероизомерлер энантиомерлерге жэне диастереомерлерге бөлінеді.
Органикалық қосылыстардың химиялық байланыс түрлері және олардың негізгі сипаттамасы.
Атомдар арасында химиялық байланыстың туындауына байланысты олар молекулаға бірігеді. Химиялық байланыс пайда болғанда энергия бөлінеді де жүйе барынша кіші энергияға ие. А + В = АВ
Химиялық байланысқа сәйкес:
Ядролардың арасындағы кеңістікте электрондық бұлт тығыздығының артуы ядроларды тартады, жақындатады және электрондардың потенциалдық энергиясын, бүтіндей барлық жүйенің энергиясын да төмендетеді.
Химиялық байланыс молекулалардың орбиталдар түзе жүретін екі немесе одан да көп атомдық орбиталдардың әрекеттесуі кезінде қарастырылады.
Ең қарапайым, жай жағдайда химиялық байланыс екі электронмен түзіледі, пайда болады немесе туындайды.
Әрекеттесуші реагенттері энергияларының айырмасына тәуелділікте, тұр- тұрпаты бойынша не реагенттер мен орбитальдар арасында орташа болатын, не реагенттердің біреуінде басымырақ ұқсас болатын молекулааралық орбитальдың түзілуі мүмкін. Сондықтан да дипольдық моментпен немесе полярлық шамасымен сипатталатын сан алуан химиялық байланыс түрін (иондық, коваленттік және иондықтан бастап коваленттікке дейінгі спектрдің бәрі) көп болуы мүмкін.
Электростатикалық тартылу есебінен иондар арасында түзілетін байланысты иондық деп атайды.
Негізінен органикалық иондар химиялық байланыстың гетеролизі (бөліміне ыдырауы, ажырасуы) нәтижесінде түзіледі.
Коваленттік байланыс.
Коваленттік байланыс әрекеттесуін атомдар өздерінің электронын бірінен- бірі беріп, екеуіне бірдей, электрон жұбын түзеді, мысалы А+ В = А – В.
Полюссіз ковалентті байланыс молекулалық орбитальдар әдісі бойынша электрондарда бірдей энергия болатын атомдар әрекеттескенде түзіледі.
Хлор молекуласының түзілуі полюссіз коваленттік байланыстың түзілуіне тән мысал болады: Cl + Cl → Cl – Cl
Егер байланыстың түзілуіне қатынасатын электрондардың энергетикалық деңгейі өзара тең болмай және ол айырмашылық аса үлкен емес, болмашы ғана мысалы, қарапайым жағдайда электртерістілік (А → В) сияқты болса, онда электрондық тығыздық А мен В ядроларының арасында бірдей теңдікте таралмайды. Ол электртерістігі артық болатын атом жағына ығысады. Мұндай жағдайдағы химиялық байланыс дипольдік моментпен сипатталатын полюске айналады, яғни байланыс полюсті болады. H + Cl = H  → Cl
→ Cl 
Байланыстың полюстігі электрондық тығыздықтың бірдей, біркелкі, теңдей таралмауымен байланысты.
Донорлы- акцепторлы байланыс.
Коваленттік байланыс пайда болғанда әрбір атом оның түзілуі үшін бір электронын береді. Нәтижесінде екі ядро өрісінде жылжитын спиндері қарсы бағытта бағытталған электрондар туындайды. Бірақ та химиялық байланыс басқа жолмен де туындауы мүмкін, айталық бір атомдар электрондық жұбы бөлінбеген, ал басқасында бос радикал бар болған жағдайда. Мұндай байланысты донорлы- акцепторлық дейді. А: + □В → А- В (Бос радикал).
N︠︠H︠3 + HCl→ [NH4]+Cl-
Сутектік байланыс.
Сутектік байланыс− донорлы- акцепторлы байланыстың бір түрі. Электртерістілігі жоғары атомдармен (N, O, F) байланысқан сутек атомында әрқашанда электрон жетіспегендәктен, ол басқа атомдардағы бөлінбегн жұбымен әрекеттесе алады.
2. Органикалық қосылыстардың кеңістіктегі құрылысы
(стереоизомерия)
А.М.Бутлеровтың химиялық қүрылыс теориясы (1861ж.) бойынша –құрамы бірдей, бірақ құрылысы әртүрлі қосылыстарды, сол себептен химиялық және физикалық қасиеттері әртүрлі қосылыстарды - изомерлер деп атайды. Изомерлер- құрылымдық және стероизомерлер (кеңістіктік) болып екіге бөлінеді.
Құрылымдық изомерлер- құрамы бірдей, бірақ тізбектің немесе сақинаның құрылысы, қос немесе үш байланыстың болуы, функционалдық топтар мен радикалдар қүрылысының өзгешелігіне байланысты болатын изомерлер.
Стереоизомерлер- құрамы мен құрылысы бірдей, бірақ атомдардың кеңістіктегі орналасу айырмашылығы бар изомерлер.

Конфигурация - а-байланыс бойындағы айналудан туындайтын өзгерістерді еске алмайтын, атомдардың кеңістікте орналасу тәртібі.
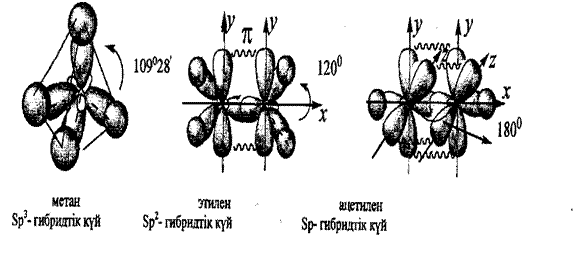
Көміртек атомының стереохимиялық ерекшеліктеріне байланысты (Вант-Гофф, 1874) органикалық қосылыстардың гибридтену түрлері- тетраэдрлық, бұрыштық жэне тузу конфигурация.™ болып бөлінеді.
Барлық стероизомерлер энантиомерлерге жэне диастереомерлерге бөлінеді.
Энантиомерлер- бір-бірімен беттеспейтін молекулалардың айнадағы бейнесі (оптикалық белсенді). Энантиомерлердің физикалық жэне химиялық қасиеттері бірдей, тек қана оптикалық белсенділіктері әр-түрлі.
Бізді қоршаған заттарды, олардың симметрия элементтерінің болу немесе болмауына байланысты -хиралды жэне ахиралды болып бөлінеді.
Өзінің айнадағы бейнесіне сэйкес келмейтін заттың ерекшелігін -хиральдыц (грекше сһеіг- қол) деп атайды. Хиралды молекулалардың симметрия жазығы және орталықтары болмайды, тек симметрия осі ғана болады. Осы осьті 180° бүрғанда молекула бастапқы күйіне қайта келеді.
Органикалық молекулалардың қүрамында бір немесе бірнеше хираль немесе ассимметриялыц орталықтары болады. Заттың оптикалық белсенділік көрсетуінің бір белгісі молекуланың қүрамындағы ассимметриялы көміртегі атомдарының болуына байланысты. Бір немесе бірнеше хираль орталығы болғанмен де кейбір молекулаларда (мезошарап қышқылы, цистин және т.б.), симметрия жазықтығы пайда болып, ол ахиралды болады.
Ассимметриялы көміртегі деп көміртек атомының төрт валенттілігі төрт түрлі орынбасарлармен байланысқан атомды айтады. Ассимметриялық көміртегі) «жүдцызшамен» белгіленеді - (С*).

Оптикалық белсенді молекулалардың конфигурациясын аныктау үшін глицерин альдегидін үлгі ретінде қодцанады. Глицерин альдегидінің екінші көміртек (С-2) атомы асимметриялық, себебі ол төрт түрлі орынбасарлармен: -СНО, -СН2ОН, -ОН, -Н байланысқан. Демек, глицерин альдегидіндегі С-2 атомы хиралдық орталық болады. Хираль орталығының санына қарап, жалпы изомерлер санын N= 2° (п- хираль орталығының саны) формуласы арқылы анықталады. Глицерин альдегидінің екі оптикалық белсенді (D- және L-) изомері бар. Кеңістіктегі молекула бейнесін қағаз бетіне көшіру үшін Фишердің проекциялық формуласы қолданылады. Фишер проекциясы бойынша -ОН тобы оң жақта орналасса - ол D- генетикалық қатарға, ал -ОН тобы сол жақта орналасса (айнадағы бейнесі)- ол L - генетикалық қатарға жатады. Стрелка арқылы оптикалық белсенді заттьвд ерітіндісінен өтетін полярланған тіке сэуленің бағытының өзгеруі көрсетіледі, сэуле оңға бұрылса (+), солға бұрылса (-) болып белгіленеді. Теориялық түрде сәуле бағытыньщ өзгеруін орынбасарлардың көмегімен анықтайды. Сағат тілін кіші орынбасарлардан үлкен орынбасарға бағыттайды.


Энантиомерлердің бірдей қоспасын (D =L) рацематтар деп атайды. Рацематтар оптикалық белсенділік көрсетпейді.
Энантиомерлерге жатпайтын стероизомерлерді диастереомерлер деп атайды (молекуланың айнадағы бейнесі емес стереоизомерлер). Диастереомерлердің физикалық және химиялық қасиеттері эр-түрлі болады. Диастереомерлер екі маңызды топқа бөлінеді- а-диастереомерлер және п-диастереомерлер.
ст-Диастереомерлер. Жай қант эритрозаның (2,3,4-үшгидроксибутаналь) күрамында бірнеше гидроксил тобы мен екі асимметриялық көміртегі (С-2, С-3) атомы бар. Эритрозада екі асимметриялык көміртегі болу себебінен, оның төрт түрлі изомері болады.
я-Диастереомерлерге- құрамында я-байланысы бар конфигурациялық изомерлер жатады. я-диастереомерия алкендерге тэн (цис- жэне транс -изомерия).
Егер қос байланыспен байланысқан көміртегі атомында бірнеше орынбасар болса, онда ол затты атау үшін Е, Z- номенклатурасын қолданады.
Е, Z - жүйесі қос байланыстағы атомдармен байланысқан орынбасарлардың үлкен-кішісі арқылы анықталады, егерде үлкен орынбасарлар қос байланыстың бір бетінде орналасса Z - деп (яғни немісше бірге деген сөздің бас эріпі), ал екі жағында орналасса Е - деп (яғни немісше қарама-қарсы деген сөздің бас эріпі) аталады.

Конформация - а-байланыс бойындагы айналу нәтижесінде туындайтын молекуланың геометриялық түрлері. ст- байланыс бойындағы айналу бүрышын - торстьщ бүрыш деп атайды. Ең кіші торстық бүрыш 60°.
Конформациялық молекулаларды өрнектеу үшін Ньюменнің проекцияльщ формулаларын қолданады.
Алифатты крсылыстардың конформациясы. и- байланыс бойындагы айналу нэтижесінде 1-Бромпропанның - тежелген, тасаланған жэне қиылған конформациялары түзіледі. Конформацияларды Ньюмен проекциясы бойынша бейнелейді:


Орталақ С-С байланыс төңірегінде айналудан пайда болған 1-бромпропанның конформацияларының арасында ең энергетикалық тиімдісі немесе түрақтысы тежелген конформация.
Циклді қосылыстардың конформациясы. Тек тетраэдрлік көміртегі атомынан құралған немесе қүрамында гетероатомдары бар бес, алты мүшелі^ циклді қосылыстар эртүрлі конформациялық түрде бола алады.
Мысалы: Цйклогексанның циклінде торстық кернеу болу салдарынан, оның молекуласы жазық бола алмайды. Сол себептен циклогексан екі конформациялық түрде кездеседі: «орындық» жэне «астау». Ең энергетикалық тиімді немесе тұрақты конформация - орындық. Әр көміртек атомы бір аксиалды (о) жэне бір экваториалды (е) сутек атомымен байланысқан, барлығы циклогександа алты аксиалды жэне сонша экваториалды сутегі атомы бар. Аксиалды сутегі симметрия осіне параллелді жоғары және төмен орналасқан, экваториалды сутегі осы оске 109,5° орналасқан.
Циклогексаннын «орындық» конформациясы


Циклогексаннын «астау» конформациясы