Целлюлоза или клетчатка представляет собой линейный гомополисахарид, состоящий из остатков β,D-глюкопиранозы, соединенных между собой β(1®4)-гликозидными связями.

Структурным повторяющимся фрагментом в целлюлозе является биозный фрагмент — ц еллобиоза. В этом фрагменте второй моносахаридный остаток β,D-глюкопиранозы повернут на 180º по отношению к предыдущему. Это позволяет целлюлозе иметь линейную структуру, дополнительно стабилизированную водородными связями. Водородные связи могут образовываться между кислородным атомом пиранозного цикла и спиртовым гидроксилом 3-го углеродного атома следующего цикла, а также между соседними цепями. Такая упаковка цепей обеспечивает высокую механическую прочность, волокнистость, нерастворимость в воде и химическую инертность, позволяющие целлюлозе формировать клеточную стенку растений.
Клетчатка является субстратом для бактерий желудочно-кишечного тракта, синтезирующих витамины группы В, способствует адсорбции токсических веществ в толстом кишечнике и их выведению, что снижает риск развития злокачественных новообразований толстого кишечника.
Простые эфиры.
Широкое применение находят также производные целлюлозы. Химическая модификация целлюлозы сводится главным образом к ее превращению в простые и сложные эфиры. Получение простых эфиров напоминает синтез Вильямсона, в котором алкилированию подвергается так называемая «щелочная целлюлоза» — кристаллический комплекс целлюлозы, щелочи и воды. Этот комплекс образуется при действии концентрированных водных растворов щелочей на целлюлозу и записывается условно как алкоголят. Стехиометрический состав комплекса зависит от температуры и концентрации щелочи.

В реакциях алкилирования, проводимых в щелочной среде (т. е. фактически со щелочной целлюлозой), наиболее активен гидроксил при С-2, наименее — при С-3. В кислой среде самым реакционноспособным является гидроксил при С-6 как стерически более доступный.
Метилцеллюлоза. Этот простой эфир может быть записан в виде [СбH7(OH)3-х(OCHз)х]n, где x — степень замещения, т. е. число метильных групп, приходящихся на одно звено. Наибольшее применение находят эфиры со степенью замещения 1,5-2 и молекулярной массой до 250-300 тыс., которые могут быть изображены следующей усредненной структурой (для степени замещения 1,5):
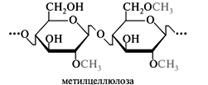
Метилцеллюлоза — бесцветное аморфное вещество, растворимое в холодной воде, глицерине и нерастворимое в большинстве органических растворителей. При температуре выше 55 °С водный раствор превращается в гель, который при охлаждении разрушается. Растворы метилцеллюлозы обладают поверхностно-активными свойствами. При высыхании растворов образуются прочные пленки. Метилцеллюлоза находит широкое применение как загуститель, эмульгатор и стабилизатор различных материалов, включая фармацевтические составы. Ее используют при изготовлении суспензий, эмульсий и гидрофобных основ мазей и линиментов.
Карбоксиметилцеллюлоза. От метилцеллюлозы этот простой эфир, сокращенно обозначаемый КМЦ, отличается наличием карбоксильной группы в метильном заместителе: [С6Н7(OН)3-х(OСН2СOOН)х]n, где x = 0,1-1,5. Получается он действием хлороуксусной кислоты или ее натриевой соли на щелочную целлюлозу, например:


КМЦ не растворяется в воде, а ее натриевая соль (по карбоксильной группе) хорошо растворима с образованием прозрачных вязких растворов. Натрий-КМЦ применяется в аналогичных целях, что и метилцеллюлоза. КМЦ с низкой степенью замещения (x = 0,1-0,2) нашла применение в качестве катионита благодаря способности обменивать протон карбоксильной группы на другие катионы. Как ионит, обменивающий анионы, используется другой простой эфир — диэтиламиноэтилцеллюлоза (сокращенно — ДЭАЭ-целлюлоза).
Сложные эфиры целлюлозы.
Среди сложных эфиров целлюлозы наиболее значимыми являются ацетаты [С6Н7(ОН)3-х(OAc)х]n и нитраты [С6Н7(ОН)3-х(ONО2)х]n.
Ацетаты целлюлозы были одним из первых синтетических материалов, используемых для получения искусственных волокон, например ацетатного шелка. Для этого пригодны высокозамещенные полимеры — триацетат (реальная степень замещения 2,8—2,9) и продукт его частичного гидролиза (x = 2,4—2,5), называемый вторичным ацетатом. Триацетат целлюлозы получают действием избытка ацилирующего агента (обычно уксусного ангидрида в присутствии кислотного катализатора):

Ацетаты целлюлозы применяются в производстве текстильных материалов, кино- и фотопленок, лаков, сигаретных фильтров, различных мембран. Они находят применение и в изготовлении готовых лекарственных форм.
Нитраты целлюлозы получают действием избытка смеси концентрированных азотной и серной кислот на хлопковую целлюлозу. Степень замещения х в общей формуле зависит в основном от соотношения кислот и остаточного количества воды в нитрующей смеси.
Продукт частичного замещения (х = 1,8-2,1), известный как коллоксилин, используется в производстве пластмасс, целлулоида, нитроэмалей и нитролаков. Почти полностью замещенная целлюлоза (х = 2,8), называемая пироксилином, относится к взрывчатым веществам и применяется при изготовлении бездымного пороха.
Гетероциклы: классификация; основы систематической номенклатуры; электронное строение ароматических пяти–, шестичленных и конденсированных гетероциклов. Представители: пиррол, индол, имидазол, оксазол, пиримидин, пурин.
Для их классификации используют следующие признаки:
[1]. По размеру цикла гетероциклические соединения чаще всего трех-, четырех-, пяти-, шести- и семичленные.
[2]. По типу элемента, входящего в состав цикла, это соединения с атомами азота, кислорода или серы.
[3]. По числу гетероатомов, входящих в цикл, наиболее распространены гетероциклы с одним и двумя гетероатомами, но известны соединения и с четырьмя атомами в одном цикле.
[4]. По природе и взаимному расположению нескольких гетероатомов возможны разнообразные комбинации (N и S, N и О и т. д.), причем гетероатомы могут занимать различные положения относительно друг друга.
[5]. По степени насыщенности гетероциклы могут быть ароматическими, ненасыщенными и насыщенными:
Химия ароматических гетероциклов изучена наиболее подробно. Полностью или частично насыщенные гетероциклы в силу особенностей их химических свойств рассматриваются, как правило, не как гетероциклические соединения, а как циклические аналоги тех или иных алифатических соединений (простые эфиры, сульфиды, вторичные амины).
[6]. По числу циклов различают моноциклические, полициклические (главным образом, конденсированные) системы. Число циклов и их типы могут быть самыми различными.
Главную сложность в номенклатуре гетероциклических соединений представляет огромное разнообразие гетероциклических структурных типов. Для многих гетероциклов в номенклатуре ИЮПАК разрешается применять тривиальные и полутривиальные названия.

Правила ИЮПАК не регламентируют положение гетероатома при написании формул гетероциклов, но традиционно гетероатом (или гетероатомы) располагают в нижней части цикла. Нумерация атомов в моноциклических соединениях всегда начинается от гетероатома. Если гетероцикл содержит различные гетероатомы (чаще всего это — азот, кислород и сера), то соблюдают следующий порядок падения старшинства атомов: О > S > N. Затем нумерацию продолжают так, чтобы другой гетероатом получил наименьший локант. При наличии в молекуле неравноценных атомов азота (=N— и —NH—) нумерация начинается от более насыщенного.
В систематической номенклатуре моноциклических соединений, содержащих один или несколько гетероатомов в цикле, используется метод Ганча-Видмана. Согласно этому методу, название гетероцикла образуют путем сочетания соответствующего префикса: окса - для атома кислорода, тиа - для атома серы, аза - для атома азота — с корнями, отражающими размер цикла (число атомов в цикле) и степень его насыщенности. Для удобства произношения буква «а» в префиксах часто опускается, поскольку корень начинается обычно с гласной буквы.

В приведенном выше названии азепина символ «Н» («обозначенный водород») применяется для уточнения положения двойных связей в системах с максимальным числом некумулированных двойных связей. Локант «обозначенного водорода» показывает, что «лишний» атом водорода находится в положении 2. Наличие нескольких одинаковый гетероатомов обозначается префиксами ди-, три- и т. д. Локанты гетероатомов указываются перед префиксом через дефис.
Названия одновалентный радикалов гетероциклических соединений обыгано получают путем добавления суффикса - ил к тривиалыному или систематическому названию исходного соединения.
Номенклатура конденсированных гетероциклических систем. Тривиальные названия.
В номенклатуре ИЮПАК разрешено использование тривиальных названий многих конденсированных гетероциклических систем.







