Напишите формулы и назовите оксиды азота, укажите степени окисления азота в каждом из них. Какой из этих оксидов более сильный окислитель? На основании электронных уравнений закончите уравнение реакции, учитывая, что азот приобретает минимальную степень окисления:
KNO2 + Al + KOH + H2O = KAlO2 + …
Решение.
Формула Наименование оксида Степени окисления
N2O оксид азота (I) +1
NO оксид азота (II) +2
N2O3 оксид азота (III) +3
NO2 оксид азота (IV) +4
N2O5 оксид азота (V) +5
Наиболее сильным окислителем является оксид азота (V), так как в этом соединении азот имеет максимальную степень окисления.
Определим, какие вещества образуются в результате реакции, приведенной в условии задачи. Минимальная степень окисления азота равна (–3). Она реализуется в аммиаке и ионе аммония NH4+. Среда щелочная, следовательно, образуется аммиак:
KNO3 + KOH + Al + H2O = KAlO2 + NH3.
Составим электронные уравнения:
8 | Al0 – 3 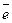 = Al3+ – окисление,
= Al3+ – окисление,
3 |  + 8
+ 8 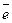 =
=  – восстановление.
– восстановление.
С учетом коэффициентов, уравнение реакции будет иметь вид:
8Al + 3KNO3 + 5KOH + 2H2O = 8KAlO2 + 3NH3.
Задания
361. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Аl ® Al2(S04)3 ® Na[Al(OH)4] ® Аl(NO3)3.
362. Составьте электронные и молекулярные уравнения реакций: а) алюминия с раствором щелочи; б) бора с концентрированной азотной кислотой.
363. Какой процесс называется алюминотермией? Составьте электронные и молекулярное уравнения реакции применения термита.
364. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: В ® Н3ВО3 ® Na2B4O7 ® Н3ВО3. Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
365. Какая степень окисления наиболее характерна для олова, и какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
366. Чем можно объяснить восстановительные свойства соединений олова(+2) и окислительные свинца(+4)? На основании электронных уравнений составьте уравнения реакций: a) SnCl2 c HgCl2; б) Рb02 с НСl конц.
367. Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия:
а) с оловом; б) с гидроксидом свинца(II).
368. Какие соединения называются карбидами и силицидами? Напишите уравнения реакции: а) карбида алюминия с водой; б) силицида магния с хлорoводородной (соляной) кислотой. Являются ли эти реакции окислительно-восстановительными? Почему?
369. На основании электронных уравнений составьте уравнение реакции фосфора с азотной кислотой, учитывая, что фосфор окисляется максимально, а азот восстанавливается минимально.
370. Почему атомы большинства р-элементов способны к реакциям диспропорционирования (самоокисления – самовосстановления)? На основании электронных уравнений напишите уравнение реакции растворения серы в концентрированном растворе щелочи. Один из продуктов содержит серу в степени окисления (+4).
371. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций H2SO3: а) с сероводородом; б) с хлором.
372. Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
373. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций HNO2: а) с бромной водой; б) с HJ.
374. Почему диоксид азота способен к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений напишите уравнение реакции растворения NО2 в гидроксиде натрия.
375. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной – с медью. Укажите окислитель и восстановитель.
376. В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения:
а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
377. Почему фосфористая кислота способна к реакциям самоокисления – самовосстановления (диспропорционнрования)? На основании электронных уравнений составьте уравнение процесса разложения Н3РО3, учитывая, что при этом фосфор приобретает минимальную и максимальную степени окисления.
378. В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите уравнения реакций: а) получения этого соединения при взаимодействии фосфида кальция с соляной кислотой; б) горения его в кислороде.
379. Какую степень окисления проявляют мышьяк, сурьма и висмут. Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой.
380. Как изменяются окислительные свойства галогенов при переходе от фтора к йоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций:
а) Cl2 + J2+ H2О =; б) KJ + Br2 =. Укажите окислитель и восстановитель.
381. Составьте электронные и молекулярные уравнения реакции, происходящей при пропускании хлора через горячий раствор гидроксида калия. К какому типу окислительно-восстановительных процессов относится данная реакция?
382. Какие реакции нужно провести для осуществления следующих превращений: NaС1 ® HCl ® Сl2 ® КСlO3. Уравнения окислительно-восстановительных реакций составьте на основании электронных уpавнений.
383. К раствору, содержащему SЬС13 и BiCl3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
384. Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия хлороводородной (соляной) и разбавленной серной кислот? Что является окислителем в первом случае, что – в двух других. Приведите примеры.
385. Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из кислот более сильный окислитель? На основании электронных уравнений закончите уравнение реакции:
KJ + NaOCl + H2SO4 ® I2 +....
Хлор приобретает минимальную степень окисления.
386. Какие реакции нужно провести, имея азот и воду, чтобы получить нитрат аммония? Составьте уравнения соответствующих реакций.
387. Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Mg2Si ® SiH4 ® SiO2 ® K2SiO3
При каких превращениях происходит окислительно-восстановительная реакция?
388. Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
SiO2 ®Si ® K2SiO3 ® H2SiO3.
Окислительно-восстановительные реакции напишите на основании электронных уравнений.
389. Как получают диоксид углерода в промышленности и в лаборатории? Напишите уравнения соответствующих реакций и реакций, с помощью которых можно осуществить следующие превращений:
NaHСО3 ® СО2 ® СаСО3 ® Са(НСO3)2.
390. Какие из солей угольной кислоты имеют наибольшее промышленное применение? Как получить соду, исходя из металлического натрия хлороводородной (соляной) кислоты, мрамора и воды? Почему в растворе соды лакмус приобретает синий цвет? Ответ подтвердите составлением уравнений соответствующих реакций.
d-элементы (...(n – l)d1-10ns0-2)






