Составьте электронные уравнения процессов, протекающих на электродах при электролизе раствора и расплава хлорида магния.
Решение.
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при пропускании электрического тока через раствор или расплав электролита. Процесс электролиза показывают в виде схемы, которая учитывает диссоциацию электролита, окисление на аноде, восстановление на катоде и образующиеся продукты.
Напишем схему электролиза расплава хлорида магния:
MgCl2 D Mg2+ + 2Cl–,
катод (-); Mg2+; Mg2+ + 2  = Mg0 – восстановление,
= Mg0 – восстановление,
анод (+); 2Cl–; 2Cl– - 2  = Cl
= Cl 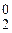 – окисление.
– окисление.
При электролизе водных растворов солей нужно учитывать и электролиз молекул воды. Так, на катоде можно ожидать восстановление не только катионов металла, но и ионов водорода по схеме:
1. Mn+ + n  = M0. (1)
= M0. (1)
2. 2H+ + 2  = 2H0; 2H0 ® H
= 2H0; 2H0 ® H 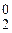 .
.
(2Н2О + 2  = Н
= Н 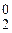 + 2ОН–) (2)
+ 2ОН–) (2)
Из этих конкурирующих процессов протекает тот, который выгоднее энергетически и для которого больше алгебраическое значение потенциала. Величина потенциала восстановления ионов водорода в нейтральном растворе равна
(– 0,41 В). Металлы, стоящие в ряду напряжений за водородом, восстанавливаются прежде, чем водород. Если значение потенциала металла намного меньше, чем (– 0,41 В), на катоде восстанавливается водород. Это – металлы, стоящие в начале ряда напряжений до алюминия включительно. Они из водных растворов не восстанавливаются. Если потенциал металла близок к (– 0,41 В), то возможно одновременное протекание (1) и (2) процессов (по ряду напряжений - это металлы от алюминия до водорода).
На аноде, если имеется несколько конкурирующих процессов, окисление протекает в последовательности:
Анионы бескислородных кислот (кроме F), например,
An– - n  = А0.
= А0.
2. Электрохимическое окисление воды по схеме
2H2O - 4  = O2 + 4H+.
= O2 + 4H+.
3. При очень высоких потенциалах разложения и из расплавов возможно окисление остатков кислородсодержащих кислот, например,
4NO  - 4
- 4  =2N2O5 + O2; 2SO
=2N2O5 + O2; 2SO 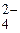 - 2
- 2  = 2SO3 + O2.
= 2SO3 + O2.
Напишем схему электролиза раствора хлорида магния:
MgCl2 D Mg2+ + 2Cl–,
H2O D H+ + OH–.
катод (-); Mg2+; H+; 2H+ + 2  = H2 – восстановление,
= H2 – восстановление,
анод (+); OH–; Cl–; 2Cl– - 2  = 2Cl0 ® Cl
= 2Cl0 ® Cl 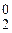 – окисление,
– окисление,
в растворе - Mg2+ + 2OH– = Mg(OH)2.






