Составьте схемы двух гальванических элементов, в одном из которых кадмий будет анодом, в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах, и посчитайте электродвижущую силу (эдс) элементов.
Решение.
Устройства, используемые для преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами. Элемент работает за счет окислительно-восстановительной реакции. Электрод, на котором идет восстановление, называется катодом. Электрод, на котором идет окисление, называется анодом. Если анод и катод изготовлены из разных металлов, то на электроде из более активного металла (с меньшим значением электродного потенциала) идет процесс окисления. Менее активный металл будет катодом и на нем протекает процесс восстановления.
Электродвижущая сила гальванического элемента равна разности значений равновесных электродных потенциалов катода и анода: ЭДС = EК - EА.
Чтобы в гальваническом элементе кадмий был катодом (E0Cd = – 0,40 В), в качестве анода нужно подобрать электрод из более активного металла, например, марганца (E0Mn = – 1,18 В).
Схема гальванического элемента:
Mn0 ê Mn2+ êê Cd2+ ê Cd0.
Напишем реакций, протекающие на электродах:
на аноде (-) Mn0 – 2 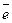 = Mn2+ – окисление,
= Mn2+ – окисление,
на катоде (+) Cd2+ + 2 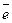 = Cd0 – восстановление,
= Cd0 – восстановление,
Mn0 + Cd2+ = Mn2+ + Cd0.
Рассчитаем ЭДС элемента по формуле
ЭДС = EК - EА = ECd - EMn = – 0,40 - (– 1,18) = 0,78 В.
Если в пару с кадмием в качестве другого электрода взять менее активный металл, например, свинец (E0Pb = – 0,13 В), то кадмий будет играть роль анода.
Схема гальванического элемента:
Cd0 ê Cd2+ êê Pb2+ ê Pb0.
Уравнения реакций протекающих на электродах:
на аноде (-) Cd0 – 2 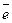 = Cd2+ – окисление,
= Cd2+ – окисление,
на катоде (+) Pb2+ + 2 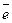 = Pb0 – восстановление.
= Pb0 – восстановление.
Рассчитаем ЭДС элемента по формуле
ЭДС = EК - EА = EPb - ECd = - 0,13 - (- 0,40) = 0,27 В.






