Вычислите величину электродного потенциала кобальта в 0,001-молярном растворе его соли.
Решение.
Значение электродного потенциала металла зависит от многих факторов – природы металла, температуры, концентрации соли и т. д. Эта зависимость выражается уравнением Нернста:
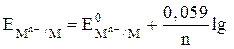 [Mn+ × mH2O],
[Mn+ × mH2O],
где EMn+/ M – определяемый электродный потенциал металла; E0Mn+/M – стандартный электродный потенциал металла; n - заряд иона металла в соли; [Mn+ × mH2O] – активная концентрация ионов металла в растворе.
Рассчитаем значение электродного потенциала кобальта в 0,001-молярном растворе его соли. Значения стандартных электродных потенциалов металлов приведены в таблице приложения:
ECo2+/ Co = E0Co2+/ Co +  lg [Co2+ × mH2O],
lg [Co2+ × mH2O],
ECo2+/ Co = – 0,27 +  lg 0,001,
lg 0,001,
ECo2+/ Co = – 0,27 + 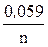 (–3),
(–3),
ECo2+/ Co = – 0,27 - 0,088,
ECo2+/ Co = – 0,358 В.






