Какое значение pH > 7 или pH < 7 имеют растворы следующих солей: Na2SO4, Na2S, NaCl, CuSO4? Ответ мотивируйте, составив молекулярные и ионные уравнения гидролиза соответствующих солей.
Решение.
Гидролиз солей - это обменная реакция между веществом и водой, ведущая к образованию слабого электролита. При это, как правило, нарушается равенство концентраций протонов и гидроксид-ионов, изменяется pH раствора. Поэтому гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой, так как они не могут дать слабых электролитов.
Если гидролизу подвергаются многозарядные ионы, гидролиз всегда протекает ступенчато с преобладанием первой стадии и образованием основных и кислых солей. Гидролиз можно усилить, если раствор подогреть или сильно разбавить.
Из солей, приведенных в условии задачи, NaCl и Na2SO4 образованы сильными основаниями и сильными кислотами, поэтому они гидролизу не подвергаются, pH растворов этих солей будет примерно равен 7.
Соль Na2S образована сильным основанием NaOH и слабой кислотой H2S. Гидролиз пойдет по слабому звену - аниону ступенчато:
Na2S D 2Na+ + S2-,
S2- + HOH D HS- + OH-,
Na2S + H2O D NaHS + NaOH.
Выше записано краткое ионное уравнение гидролиза. Чтобы написать на его основе молекулярное уравнение, необходимо к ионам уравнения дописать до компенсации зарядов противоионы от исходной соли, в данном случае ионы Na+.
Соль CuSO4 образована слабым основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз пойдет по слабому звену - катиону Cu2+:
CuSO4 D Cu2+ + SO 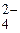 .
.
Краткое ионное уравнение гидролиза:
Cu2+ + HOH D (CuOH)+ + H+.
Молекулярное уравнение гидролиза:
2CuSO4 + 2H2O D (CuOH)2SO4 + H2SO4.






