В основе потенциометрического метода лежит зависимость равновесного электродного потенциала от активности (концентрации) ионов в растворе, в котором находится электрод. В потенциометрии измеряют электродвижущую силу (ЭДС) электрохимической ячейки, равную разности потенциалов индикаторного электрода и электрода сравнения. Когда между электродом и раствором устанавливается обратимое динамическое равновесие с участием потенциалопределяющих ионов, то независимо от природы электрода на нем возникает равновесный потенциал Е, описываемый уравнением Нернста:
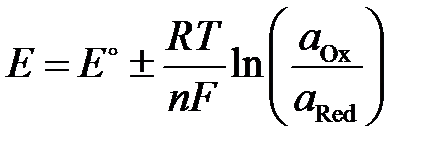 , (4.1)
, (4.1)
где 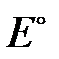 – стандартный электродный потенциал системы Ox/Red при их активностях, равных 1 (a Ox= a Red=1), B; R – универсальная газовая постоянная, R = 8.314 Дж×моль–1; T – абсолютная температура, К; F – постоянная Фарадея, F = 96487 Кл×(моль×экв)–1; n – число электронов, участвующих в реакции восстановления (со знаком «+») или окисления (со знаком «–»); a Ox, a Red – активности, соответственно окисленной и восстановленной форм потенциалопределяющих ионов, моль×л–1. Если восстановленная форма является твердой фазой, то ее активность принимается равной 1 (
– стандартный электродный потенциал системы Ox/Red при их активностях, равных 1 (a Ox= a Red=1), B; R – универсальная газовая постоянная, R = 8.314 Дж×моль–1; T – абсолютная температура, К; F – постоянная Фарадея, F = 96487 Кл×(моль×экв)–1; n – число электронов, участвующих в реакции восстановления (со знаком «+») или окисления (со знаком «–»); a Ox, a Red – активности, соответственно окисленной и восстановленной форм потенциалопределяющих ионов, моль×л–1. Если восстановленная форма является твердой фазой, то ее активность принимается равной 1 (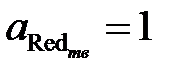 ).
).
Заменяя в уравнении (4.1) константы R и F их численными значениями, а натуральный логарифм десятичным, при температуре 298 К (25 °С) для реакции восстановления, получаем:
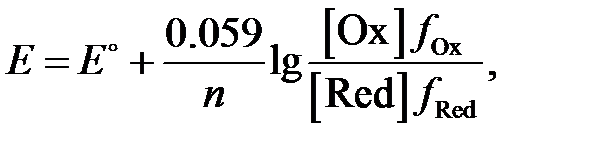 (4.2)
(4.2)
где [Ox], [Red] – равновесные концентрации окисленной и восстановленной форм потенциалопределяющей системы, моль×л–1; f Ox, f Red– коэффициенты активности окисленной и восстановленной форм системы, соответственно.
В расчетах, не требующих большой точности, можно пользоваться уравнением Нернста в концентрационной форме, но при точных расчетах с концентрацией растворов, превышающих 10–3 моль×л–1, необходимо использовать активности.
Электроды, применяемые в потенциометрии
Индикаторные электроды
В потенциометрии в качестве индикаторных электродов применяют как классические металлические электроды, в которых электрический ток между электродом и раствором переносится электронами, так и мембранные, называемые ионселективными электродами, в которых электрический ток переносится ионами. Металлические электроды подразделяют на активные и инертные. Активные металлические электроды изготавливают из металлов, образующих восстановленную форму одноименных ионов (Ag, Pb, Cu, Cd). Потенциал таких электродов является функцией активности собственных (одноименных) ионов в растворе, например, для серебряного индикаторного электрода при равновесии:
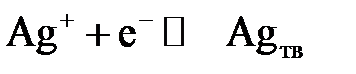
величина потенциала выражается уравнением:
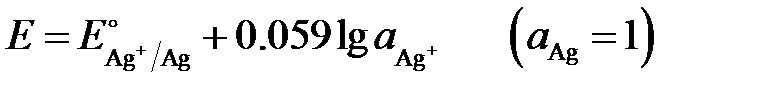 .
.
Активные металлические электроды называют электродами первого рода.
Если металлический электрод покрыт слоем его малорастворимой соли, то такой электрод становится чувствительным к концентрации аниона этой соли. Например, в растворе, содержащем хлорид-ионы, потенциал хлоридсеребряного электрода линейно зависит от активности ионов Cl–:
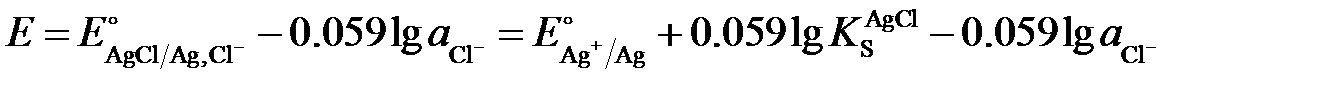 ,
,
где 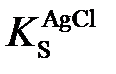 – произведение растворимости AgCl.
– произведение растворимости AgCl.
Такие электроды (AgCl/Ag,Cl–, AgBr/Ag,Br–, Ag2S/Ag,S2–, Hg2Cl2/Hg,Cl–, HgO/Hg,OH–) называют электродами второго рода.
Инертные металлические электроды (Pt, Au), являясь «переносчиками» электронов, используются для измерения потенциала (ЭДС) в растворах, содержащих равновесные окислительно-восстановительные системы, непосредственно с электродом не взаимодействующие, но так же подчиняющиеся уравнению Нернста.
Мембранные (ионселективные) электроды обладают селективной чувствительностью к определенному сорту потенциалопределяющих ионов в присутствии посторонних. В основе действия ионселективных электродов лежит способность ионов, входящих в состав мембраны электрода, обмениваться на определенный сорт ионов анализируемого раствора. Наиболее распространенным ионселективным электродом, исключительно чувствительным к концентрации ионов водорода, является стеклянный электрод, где в качестве ионообменной мембраны используется стекло, состава 10% Li2O, 10% CaO и 80% SiO2.
Электроды сравнения
Электроды сравнения служат эталонами, по отношению к которым измеряют потенциал индикаторного электрода. Электрод сравнения должен обладать постоянным и независящим от состава раствора потенциалом. Обычно в качестве электродов сравнения используют водородный (нормальный водородный) и электроды второго рода: хлоридсеребряный, каломельный, ртутносульфатный.
Хлоридсеребряный электрод (рис. 4.2 a) состоит из камеры (1), заполненной смесью хлорида серебра и хлорида калия, в этой камере помещается серебряная проволока (2), выполняющая роль электрода. К камере прикреплен стеклянный сосуд (3), заполняемый насыщенным раствором хлорида калия. Гидравлически камера и сосуд соединены с помощью стеклянной трубки (4), заполненной асбестовым волокном, по которому раствор поступает в камеру и смачивает пасту из KCl и AgCl. В нижней части электрода имеется электролитический ключ (5), представляющий собой капилляр, заполненный пористым материалом - асбестом или стекловолокном. Потенциал насыщенного хлоридсеребряного электрода (полуреакция 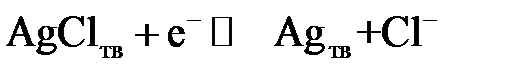 ) относительно нормального водородного электрода равен 201 ± 1 мВ.
) относительно нормального водородного электрода равен 201 ± 1 мВ.
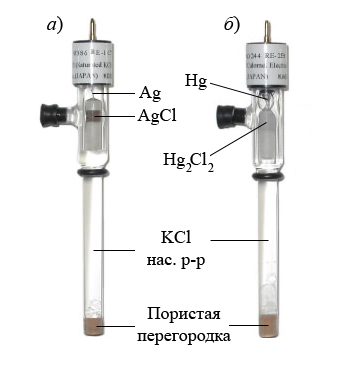
Рисунок 4.2 – Устройство хлоридсеребряного (а) и каломельного (б) электродов сравнения.
Каломельный электрод (Pt|Hg|Hg2Cl2|Cl–) (рис. 4.2 б) состоит из платиновой проволочки, погружённой в каплю ртути, помещённую в насыщенный каломелью раствор хлорида калия определённой концентрации. Уравнение окислительно-восстановительного процесса, протекающего в каломельном электроде:
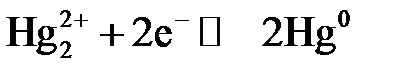 ,
,
Уравнение Нернста для него может быть записано следующим образом:
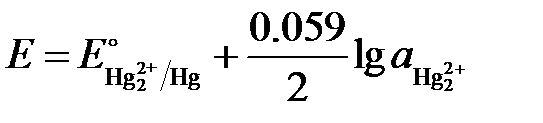 .
.
Поскольку каломель является малорастворимым соединением, активность ионов Hg22+ связана с активностью хлорид-ионов через величину произведения растворимости 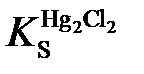 :
:
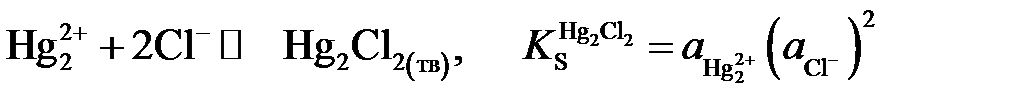 .
.
С учётом этого уравнение Нернста для полуреакции
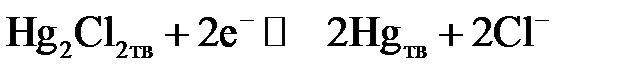
может быть записано следующим образом:
 .
.
Потенциал каломельного электрода зависит только от температуры и активности хлорид-ионов. На практике обычно используется насыщенный раствор KCl; в этом случае потенциал насыщенного каломельного электрода зависит только от температуры и составляет 0.2412 В при 25 °С.
Достоинством насыщенного каломельного электрода является хорошая воспроизводимость потенциала. Электрод работоспособен при температурах до 80 °С; при более высоких температурах начинается разложение каломели. Ввиду токсичности ртути, содержащейся в каломельных электродах, в настоящее время они применяются сравнительно редко.






