Присутствие белков в пищевых объектах устанавливается с помощью качественных реакций, которые условно разделяют на две группы:
а) цветные реакции;
б) реакции осаждения.
Среди первой группы различают универсальные реакции (биуретовая на пептидные связи и нингидриновая на α-аминокислоты) и специфические, обусловленные присутствием в белках остатков определенных аминокислот. Так, ксантопротеиновая реакция свидетельствует о наличии в белках остатков ароматических аминокислот, реакция Паули – гистидина и тирозина, Адамкевича и Вуазене – триптофана, нитропруссидная – цистеина, а реакция Сакагучи – аргинина. По результатам специфических реакций ориентировочно можно судить о пищевой ценности белков.
Во второй группе реакций белки осаждают действием солей, органических растворителей, концентрированных кислот, щелочей, ионов тяжелых металлов, температуры и в изоэлектрической точке. Белки в растворенном состоянии крайне неустойчивы, поэтому при добавлении органических растворителей (спирт, ацетон), концентрированных растворов нейтральных солей щелочных металлов и воздействии физических факторов (нагревание, облучение, ультразвук) гидратная оболочка разрушается и они выпадают в осадок.
Так как белковые вещества сырья (муки, крупы, молока, мяса), включая ферменты, часто являются определяющими в обеспечении качества пищевых изделий, то для изучения физико-химических, биохимических и физиологических свойств этих соединений обязательным условием является получение белков в индивидуальном и, по возможности, неденатурированном состоянии. Белки обычно теряют природные (нативные) свойства (растворимость, гидратацию, ферментативную активность и т.д.), подвергаясь денатурации под влиянием различных факторов. Типичным примером необратимой денатурации белков является выпадение их в осадок под действием ТХУ. Длительный контакт со спиртом также приводит к необратимой денатурации белка. Денатурирующее действие различных факторов на белки можно смягчить, если проводить операции выделения их при температуре не выше +4°С.
Методы выделения и очистки белков. Общая схема операций по выделению белков сводится к измельчению биологического материала (гомогенизации), экстрагированию и собственно выделению, то есть очистке и получению белка в индивидуальном состоянии. При изучении метаболических процессов в живых организмах (в созревшем зерне, плодах, овощах) морфологическая и биохимическая целостность клеток и тканей сохраняется в максимальной степени, тогда как при исследовании состава сырья и готовых пищевых продуктов потеря целостности структуры несущественна. Гомогенизацию объектов следует рассматривать как начальную стадию выделения белков, но способ ее определяется постановкой задачи. Например, анализ ферментов из растительных материалов часто затруднен тем, что при гомогенизации экстрагируется большое количество фенолов, которые взаимодействуют с карбонильными группами пептидных групп при помощи водородных связей и вызывают денатурацию белка и потерю ферментами своей активности. Добавление в экстракт поливинилпирролидона, образующего с фенолами нерастворимые комплексы, предотвращает инактивацию ферментов.
Разрушение клеточной структуры осуществляется тщательным измельчением материала в гомогенизаторах, мельницах, попеременным замораживанием и оттаиванием, применением ультразвуковых высокочастотных колебаний, пресс-методов с использованием высоких давлений и метода "азотной бомбы". В последнем случае клетки насыщаются азотом под давлением, которое затем сбрасывается и клетки разрушаются. Эффективность гомогенизации зависит не только от способа разрушения клеточных структур, но и от вида анализируемого материала. Животные клетки разрушаются относительно легко, особенно в отсутствие сосудистой и соединительной ткани, тогда как растительные и микробные – из-за присутствия клеточных стенок – трудно. В таком случае применяют методы растирания материала с твердыми веществами (песок, абразивный порошок) или обработку клеточных стенок лизоцимом или ферментными препаратами, содержащими целлюлазу, хитиназу и липазу. Гомогенизацию рекомендуется проводить в холодных комнатах или с использованием льда.
Экстракция белков может быть совмещена с гомогенизацией клеток и тканей либо проведена отдельно, если продукт заранее измельчен. Для определения ферментативной активности белка достаточно одноразовой экстракции, тогда как для количественного определения белковых фракций зерна – трех- или пятикратной. Условия экстрагирования белков (время, гидромодуль, температура и т.д.) подбираются эмпирически, основываясь на методиках ведущих научных школ.
Большинство белков животных тканей хорошо растворимы в 5–10% растворах солей, тогда как для перевода в раствор белков зерновых культур применяют более широкий набор растворителей. Для этого используются буферные системы со значениями рН от кислых до слабощелочных (фосфатные, боратные, цитратные, трис-HCl), органические растворители и неионные детергенты, разрывающие белок-липидные или белок-белковые связи:
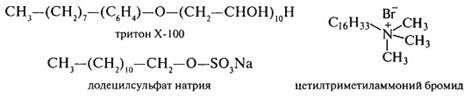
Растворители подбираются с учетом разрыва в белках определенных типов связей. Так, уксусная кислота ослабляет ионные связи, сообщая молекулам одноименные положительные заряды, мочевина – водородные и гидрофобные, салицилат натрия и ДДС-Na – гидрофобные и ионные, а водные растворы спиртов – водородные и гидрофобные взаимодействия. Органические растворители разрывают белок-липидные связи.
При изучении физико-химических свойств белков и их превращений в пищевых системах широко используют методы фракционирования и очистки от небелковых соединений. Они основаны на различиях таких свойств белков, как размер молекул, растворимость, заряд и сродство к специфическим химическим группам.
Осаждение белков из раствора под действием солей щелочных и щелочноземельных металлов называют высаливанием. Для высаливания чаще применяется сульфат аммония, под влиянием которого белки, как правило, сохраняют растворимость и ферментативную активность. Главную роль при высаливании играет не природа солей, а валентность ионов, действие которых оценивается по ионной силе (μ): μ = ½ ∑CV2,
где С – концентрация каждого вида иона;
V – валентность ионов.
Глобулины выпадают в осадок при 50% насыщении, альбумины – при 100% насыщении растворов солей, а при ступенчатом фракционировании (20–100% насыщения) выпадают белки и других классов (проламины, глютелины).
В практике выделения и очистки белков используются различные типы хроматографии: адсорбционная, распределительная, ионообменная и хроматография по сродству. Адсорбционная хроматография основана на различиях в полярности белков. В колонке вместе с буферным раствором упаковывают адсорбент, на который в небольшом объеме растворителя наносят исследуемый образец. Компоненты разделяемой смеси адсорбируются, затем элюируются с помощью буферного раствора с увеличивающейся концентрацией или полярностью. Фракции белка собирают с помощью автоматического коллектора фракций.
В распределительной хроматографии, в отличие от адсорбционной, в качестве неподвижной фазы выступает водный слой, удерживаемый твердой фазой (силикагель, бумага). Разделяемые вещества многократно распределяются между водным слоем и движущейся фазой растворителя и с разной скоростью перемещаются подлине колонки или бумаге. Распределительную хроматографию на бумаге часто используют для анализа пептидов и аминокислот. Адсорбентом служат нити целлюлозы, а растворителем – смесь органических растворителей, например: бутиловый спирт–уксусная кислота–вода. Хроматограмму проявляют, высушивают и анализируют местонахождение разделяемых компонентов тем или иным способом.
Методом ионообменной хроматографии белки или аминокислоты разделяют на основе различий в общем заряде молекул. Если белок в нейтральной среде (рН 7) имеет положительный заряд, то он связывается на колонке с ионообменником, содержащим фенольные, сульфо- и карбоксильные группы (катионообменник), если отрицательный, то – на колонке с ионообменником, представленным аминами или органическими основаниями (анионообменник). Чаще всего для фракционирования белков используют производные полистирола и целлюлозы:

Положительно заряженный белок снимается с колонки с помощью раствора хлористого натрия или изменением рН элюирующего буфера. При этом ионы натрия конкурируют с положительно заряженными группами белков.
Белки с меньшим положительным зарядом вымываются с колонки первыми, с большим зарядом – последними.
Хроматография по сродству (аффинная хроматография,) основана на принципе избирательного связывания белков со специфическими веществами (лигандами), прикрепленными к носителю. Лиганд (глюкозу) ковалентно присоединяют к носителю (проводят иммобилизацию) и наносят на колонку исследуемую белковую смесь. Несвязавшиеся белки удаляют соответствующим буфером, а нужный белок элюируют раствором, содержащим лиганд в очень высокой концентрации. При этом присоединенные к колонке остатки глюкозы в молекуле белка замещаются на глюкозу, находящуюся в растворе (рис. 2.20).

Рис. 2.20. Хроматография по сродству (афинная хроматография)

Рис. 2.21.Распределение молекул белка среди гранул сефадекса
Гель-фильтрация, или метод молекулярных сит заключается в пропускании белков через колонку с гелем сефадекса или других типов (агарозных, полистирольных). Применяются также пористые стеклянные шарики и пористый кварц (порасил). Наибольшее распространение получили декстрановые гели (сефадекс), являющиеся продуктом поперечного сшивания полисахаридных цепочек декстрана. Зерна сефадексов разных номеров содержат поры разных размеров, в которые могут проникать белки с определенной молекулярной массой. Низкомолекулярные белки распределяются в растворенном виде как внутри частиц полимера, так и между ними, а высокомолекулярные – только между частицами, поэтому вторые быстрее проходят через колонку и первыми вытекают из нее (рис. 2.21). В итоге белки распределяются по молекулярной массе и могут быть собраны в виде отдельных хроматографических фракций (рис. 2.22).

Рис. 2.22.Картина распределения смеси веществ, различающихся по молекулярным массам, при методе гель-фильтрации
Принцип методов электрофоретического разделения заключается в способности молекул пептидов и аминокислот, находясь в заряженной форме в виде катионов (+) или анионов (–), передвигаться в электрическом поле с определенной скоростью. Кроме того, молекулы с близкими зарядами, но разными размерами, отличаются отношением заряда к массе. Все эти различия и обуславливают высокую разрешающую способность электрофоретических методов. Скорость миграции белков в электрическом поле (V) зависит от напряжения электрического поля(ε), заряда белков (z) и сопротивления трения (О-Сопротивление трения определяется размерами, формой белка, значениями рН и концентрацией буфера. Указанные величины связаны между собой соотношением: V = ε · z / f.
Впервые метод электрофореза был разработан Тизелиусом с применением бумаги в качестве носителя и специальных оптических устройств, регистрирующих передвижение границы раздела раствора белка и растворителя по показателям преломления (фронтальный электрофорез). В настоящее время распространены методы зонального электрофореза, предусматривающие использование крахмальных и полиакриламидных гелей (ПААГ). Наиболее распространенным методом фракционирования белков является диск-электрофорез (от англ, discontinuous – прерывистый) в ПААГ, при котором используется пара буферных растворов с различными значениями рН в присутствии ДДС-Na и гели различной пористости (концентрирующие и разделяющие) (Laemmli, 1970). Для обнаружения белков гели обрабатывают красителями: амидовым черным 10В, кумасси синим R-250. Интенсивность окраски, а по ней количественное содержание белковых фракций, определяют сканированием на денситометре.
Для электрофоретического разделения белков и пептидов успешно применяется двумерный электрофорез в ПААГ. В соответствии с этим методом смесь компонентов разделяют сначала в столбиках геля электрофорезом в горизонтальном направлении, затем в гелевых пластинах – в вертикальном (рис. 2.23). При разделении белков, например гороха, этим методом удалось получить более 150 различных компонентов.

Рис. 2.23.Двумерный электрофорез
Очень высокую разрешающую способность имеет метод изоэлектрического фокусирования белков, в основе которого лежит фронтальный электрофорез, проводимый на колонке одновременно в градиенте рН и напряжения. Колонку предварительно заполняют носителями с синтетическими смесями полиаминополикарбоновых кислот (амфолитами), затем сверху в нее подают раствор сильной кислоты, снизу – сильнощелочной раствор для того, чтобы установить градиент рН с крайними значениями, соответствующими рН кислого и щелочного растворов. Амфолиты прекращают движение по колонке, когда их суммарный заряд становится равным нулю, и тем самым стабилизируют исходный градиент рН. В подготовленную колонку вносят образец исследуемой смеси, компоненты которой распределяются по зонам со значениями рН, характерными их изоэлектрическим точкам.
В химии пищевого белка применяют и другие разновидности электрофоретическогоразделения (иммуноэлектрофорез, изотахофорез), а также метод пептидных карт и ультрацентрифугирование. Метод пептидных карт (отпечатков пальцев) относится к методам двумерного разделения и наиболее часто используется для анализа пептидов.
Пептиды получают избирательным гидролизом белков, затем на бумаге их разделяют в горизонтальном направлении электрофорезом, в вертикальном – распределительной хроматографией. Пептиды окрашивают нингидрином, элюируют и определяют аминокислотный состав.
В методе ультрафильтрации белки в градиенте плотности распределяются на разных уровнях центрифужной пробирки в процессе седиментации (осаждения) в виде отдельных зон. Для создания градиента используют соли тяжелых металлов и растворы сахарозы. Метод широко применяется для определения молекулярных масс белков по константе седиментации (S), которая зависит от массы и формы белковых частиц: S = v/(w2 · r),
где v – скорость перемещения границы растворитель–белок, см/с;
w– угловая скорость ротора, рад/с; г – расстояние от центра ротора до середины ячейки с раствором белка.
Величина S, равная 1 · 10-13 с, принята за единицу и названа сведбергом (S) в честь Т. Сведберга, впервые сконструировавшего ультрацентрифугу.
Очистка белков от низкомолекулярных соединений (солей, сахаров, аминокислот) осуществляется методами диализа, гель-фильтрации на сефадексе G-25, кристаллизации, ультрафильтрации и с помощью полых волокон. При диализе используют полупроницаемые мембраны (целлофан, коллодийная пленка), через которые белки не диффундируют и остаются внутри диализного мешочка. Более мелкие молекулы проходят через поры диализной мембраны и выходят в диализат. В методе ультрафильтрации, который применяется, например, в производстве сывороточных белков молока, соевых белковых изолятов, по обе стороны мембраны создается разность давлений за счет продавливания фильтруемого белкового раствора. В качестве мембран используются целлюлозные пленки и нецеллюлозные полиэлектролитные комплексы. Аналогично мембранам по принципу молекулярного сита действуют и полые волокна. Белковый раствор помещается с внешней стороны волокон, и создается разность давления за счет повышения его в растворе или понижения внутри их.
Гомогенность белка определяется на последнем этапе выделения и очистки с применением по меньшей мере двух методов, оценивающих то или иное физико-химическое свойство. Наиболее достоверными являются ультрацентрифугирование в градиенте плотности, диск-электрофорез в ПААГ, иммунохимические методы и растворимость. Если белок при электрофорезе представлен только одной полосой и обладает при этом максимальной биологической активностью, то он считается гомогенным. Для гомогенного белка на кривой растворимости (зависимости растворенного белка от общего его количества в постоянном объеме растворителя) имеется только один перегиб, тогда как для гетерогенного – столько, сколько в нем индивидуальных компонентов.
Содержание белка в пищевых объектах обычно определяют по количеству азота с использованием метода Кьельдаля. С целью упрощения и сокращения длительности анализа этот метод с момента его разработки (1983) неоднократно модифицировался с применением различных катализаторов и условий минерализации. На основе модифицированных методов созданы высокопроизводительные автоматические анализаторы типа "Кьельфос", стоимость определения содержания белка на которых и сегодня остается высокой. Существует и некоторая условность в методе Кьельдаля при расчете количества белка, заключающаяся в использовании переводного коэффициента. Однако, несмотря на недостатки, метод Кьельдаля является унифициованным, он включен в ГОСТы на многие пищевые продукты.
Для перевода количества азота в содержание белка используют коэффициент 6,25. Принят он потому, что большинство белков содержит 16% азота (100/6,25 = 16). Однако более правильным является использование коэффициентов, соответствующих фактическому содержанию сырого белка в каждом его виде. Так, для пшеницы получен коэффициент 5,7, так как ее белки содержат 17,5% азота. Для других белковых ресурсов коэффициенты перевода приняты следующими: 5,7 – рожь, ячмень, овес, семена подсолнечника; 5,8 – соя; 6,25 – кукуруза, мясо; 6,38 – молоко.
Имеются и другие методы определения азота, такие как метод Дюма, нейтронно-активационный и с фенолятгипохлоритом на приборе "Техникон". Принцип метода Дюма заключается в разложении органического соединения в атмосфере оксида углерода до газообразного состояния с последующим измерением объема азота (N2). В нейтронно-активационном методе атомы азота образца бомбардируются нейтронами в ядерном реакторе с получением изотопа 13N. Содержание белка рассчитывают по количеству гамма-лучей. Определение азота на приборе "Техникон" осуществляется колориметрическим способом, в котором измеряется интенсивность сине-голубой окраски, образующейся по реакции взаимодействия сульфата аммония, выделяющегося в процессе минерализации образца, с щелочным раствором фенола и гипохлорита. Все описанные здесь методы по точности анализа не уступают методу Кьельдаля, однако они являются достаточно дорогими.
Широкое распространение получил метод инфракрасной спектроскопии, в основе которого лежит поглощение белками света с определенной длиной волны и измерение интенсивности его отражения в приборах-анализаторах. Приборы калибруют по образцам зерна (эталонам) с известным содержанием белка, определяемым по методу Кьельдаля.
Известны методы количественного определения белка, основанные на различной степени помутнения (нефелометрический метод), способности белков адсорбировать красители (кумасси синий R-250, амидочерный и др.) и преломлять лучи света (по показателю преломления). Они характеризуются высокой точностью и простотой определения, хотя имеют ряд ограничений. Наиболее удобными являются методы с кумасси синим, биуретовый и Лоури. В основе биуретового метода лежит биуретовая реакция, в основе метода Лоури – восстановление фосфомолибденовой кислоты тирозином и триптофаном с одновременным протеканием биуретовой реакции. По оптической плотности с использованием калибровочных графиков находят концентрацию белка в растворах.
Контрольные вопросы
Какова роль белков в питании человека? Что такое азотистый баланс и какие его виды могут наблюдаться в организме?
Каковы рекомендуемые нормы белка в питании и от каких факторов они зависят?
Дайте характеристику проблемы дефицита белка и каковы пути ее решения? Какова роль нетрадиционного растительного и животного сырья для пополнения ресурсов пищевого белка?
Что такое синдром квашиоркора и каковы его последствия?
Что включают в себя понятия пищевая и биологическая ценность белков? Как определяется биологическая ценность белков?
Какие свойства характерны для аминокислот?
Какова специфическая роль отдельных аминокислот (цистеина, тирозина, фенилаланина, метионина, глутаминовой и аспарагиновой) в организме?
Как классифицируются биологически активные пептиды в соответствии с их функциями в организме и в составе пищи? Дайте краткую характеристику представителям групп пептидов.
Каковы особенности аминокислотного состава белков злаковых культур по сравнению с белками бобовых и масличных культур?
Назовите основные отличия фракционного состава белков злаковых культур (на примере пшеницы) от белков бобовых и масличных культур.
Каковы отличия физико-химических свойств и структурных особенностей двух фракций клейковины пшеницы: глиадина и глютенина? Какова их роль в обеспечении реологических свойств теста и качества хлеба?
Дайте характеристику фракционного состава и особенностей структуры белков мяса и молока.
Что включает в себя понятие "новые формы белковой пищи" и какова их роль в обогащении пищи лимитирующими аминокислотами?
Дайте определение функциональным свойствам белков.
Перечислите основные функциональные свойства белков. Какова их роль в технологических процессах производства пищевых продуктов?
Какие физико-химические и химические превращения претерпевают белки в технологическом потоке производства пищевых продуктов?
Какие методы качественного и количественного определения белков вы знаете?
ГЛАВА 3. УГЛЕВОДЫ
Название "углеводы" было дано соединениям этого класса почти 90 лет назад, когда полагали, что все они содержат углерод, водород и кислород в таких соотношениях, как будто представляют собой различные гидраты углерода общей формулы Cn(H2O)m. В дальнейшем оказалось, что ряд соединений, принадлежащих по своим свойствам к классу углеводов, содержат водород и кислород в несколько иной пропорции, чем указано в общей формуле (например, дезоксирибоза – С5Н10О4). Однако название "углеводы" сохранилось, хотя химического смысла оно не имеет.
Углеводы широко распространены в природе, они встречаются в свободной или связанной форме в любой растительной, животной или бактериальной клетке. Углеводы составляют три четверти биологического мира и примерно 60–80% калорийности пищевого рациона.
Наиболее распространенный углевод – целлюлоза, структурный компонент деревьев и других растений. Главный пищевой ингредиент – крахмал. Моносахариды встречаются в свободном виде в природе в небольших количествах; в основном они присутствуют как структурные единицы полисахаридов, входят в дисахариды и олигосахариды.






