Мясо, молоко и получаемые из них продукты содержат необходимые организму белки, которые благоприятно сбалансированы и хорошо усваиваются. Белки мышечной ткани мяса животных полноценны, по сбалансированности аминокислот говядина, баранина и свинина мало отличаются друг от друга. Белки соединительной ткани и хрящей являются неполноценными. В организме человека и животных белки мышц выполняют сократительную функцию, белки соединительной ткани и хрящей - структурную. Функции всех этих видов белков основаны на их фибриллярной природе.
Содержание белка в мясных продуктах колеблется от 11 до 22%. Главными мышечными белками являются миозин и актин, молекулярная функция которых заключается в обеспечении механизма мышечного сокращения и расслабления при участии АТФ. Миозин по массе составляет 55% мышечного белка и представляет собой гексамер с молекулярной массой 460 кД. Гексамер включает фибриллярную часть (две переплетенные а-спирали с молекулярной массой 200 кД, заканчивающиеся глобулярными "головками"), тяжелые цепи и две пары легких цепей (молекулярная масса 15-27 кД). Миозин обладает АТФ-гидро-лизующей активностью и способностью связываться с нерастворимым F-актином. Актин - это мономерный глобулярный белок с молекулярной массой 43 кД (G-актин), на долю которого приходится 25% общей массы мышечного белка. В присутствии магния G-актин подвергается нековалентной полимеризации с образованием двойной спиральной цепочки, получившей название F-актина. Мышечное сокращение заключается в повторяющихся присоединениях и отсоединениях глобулярной "головки" миозина от нити F-актина. Гидролиз АТФ запускает цикл ассоциации и диссоциации актина и миозина в пяти реакциях данного процесса (рис. 2.16).
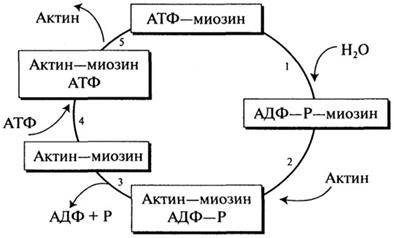
Рис. 2.16.Цикл мышечного сокращения
Сущность же процесса расслабления мышцы заключается в отделении миозиновой (АТФ) головки от F-актина.
В мышечных клетках содержится глобулярный водорастворимый хромопротеид миоглобин, имеющий в качестве простетической группы гем-циклический тетрапиррол, присутствием которого объясняется красный цвет этого белка. Тетрапирролы состоят из четырех молекул пиррола, связанных четырьмя а-метиленовыми мостиками с образованием плоской кольцевой структуры. В центре плоского кольца находится один атом железа в ферро-состоянии (Fe2+), окисление которого приводит к потере биологической активности миоглобина.

Биологическая функция миоглобина заключается не в транспортировании кислорода, как у гемоглобина, а в его запасании. В условиях кислородного голодания (например, при физической нагрузке) кислород высвобождается из комплекса с миоглобином и поступает в митохондрии мышечных клеток, где осуществляется синтез АТФ (окислительное фосфорил ирование).
На примере миоглобина хорошо изучена взаимосвязь функции глобулярного белка и его структуры. Миоглобин состоит из одной полипептидной цепи с молекулярной массой 17 кД, включающей 153 остатка аминокислот. Примерно 75% остатков образуют восемь правых α-спиралей, уложенных в компактную сферическую молекулу. В местах изгиба полипептидной цепи расположены остатки пролина, серина, треонина, которые не способны к образованию α-спирали. На поверхности молекулы находятся полярные остатки, а внутри - неполярные, если не считать двух остатков гистидина, принимающих участие в связывании кислорода. Присоединение кислорода к миоглобину сопровождается смещением атома железа, а вместе с ним гистидина, и ковалентно связанных других остатков аминокислот в направлении плоскости гемового кольца. В результате эта область белковой молекулы принимает новую конформацию.
Миоглобин, не связанный с кислородом, называют дезоксимиогло-бином (Mb), оксигемированный Mb называют оксимиоглобином (МЬО2). Окраска мясопродуктов зависит от содержания миоглобина, состояния тема и белковой части макроглобулы. Окисление Fe2+в миоглобине до Fe3+приводит к изменению окраски пигмента от ярко-красного до темно-коричневого, так как образующийся метмиоглобин (MetMb) теряет способность связывать молекулярный кислород. Тепловая денатурация глобина также приводит к потере способности гемового пигмента связывать кислород и ухудшает цвет изделий.
Кислород миоглобина может замещаться такими лигандами, как оксид азота, оксид углерода и др., поэтому данное свойство белка мышечной ткани мяса используется для получения интенсивной окраски мясопродуктов. Нитрит (NO), применяемый для этой цели, вступая в реакцию с миоглобином, образует нитрозомиоглобин, переходящий при нагревании в устойчивый пигмент красного цвета нитрозомиохромоген:

Миоглобин и его производные имеют разные спектральные характеристики, поэтому для их идентификации при оценке качества мяса применяют спектрофотометрические методы анализа.
Наиболее распространенным белком в животном мире является коллаген - главная макромолекула кожи, сухожилий, кровеносных сосудов, костей, роговицы глаза и хрящей. Он обеспечивает внеклеточную структуру в соединительной животной ткани, существуя не менее чем в пяти различных типах. Главной особенностью коллагеновых молекул является трехспиральная структура, каждая α-цепь (субъединица) которой представляет левозакрученную спираль. В спирали на каждый виток приходится по три аминокислотных остатка. Три левые а-спирали закручиваются в правые суперспирали, которые в свою очередь объединяются в фибриллы.
Еще одной характерной особенностью молекулы коллагена является наличие в ее составе в качестве третьего остатка тройной спирали а-цепи глицина. Повторяющуюся структуру можно представить как 1ли-X--Y, где X, Y - другие аминокислоты. Около 100 Х- и 100 Y-положений в коллагене занято пролином и 4-гидроксипролином, соответственно (см. Аминокислоты и их некоторые функции в организме). В некоторых Х-положениях содержится 3-гидроксипролин, а в Y - 5-гидроксилизин. Остатки "жестких" аминокислот увеличивают стабильность тройной спирали. По количеству оксипролина определяют степень развариваемости коллагена при оценке качества мяса.
Коллаген - внеклеточный белок, но он синтезируется внутри клетки в виде молекул-предшественников, проходя через эндоплазматический ретикулум и комплекс Гольджи. В результате процесса посттрансляционной модификации тройная спираль коллагена стабилизируется между внутрицепочными дисульфидными связями, о-гликозидными связями между остатками сахаридов и гидроксилизина и перекрестным связыванием цепей и спиральных молекул фибрилл через Шиффовы основания (см. гл. 3) и альдольную конденсацию.
Близкий по свойствам к коллагену, в эластичных фибриллах соединительной ткани обнаружен белок эластин, содержащийся в связках и стенках кровеносных сосудов. Этот белок богат глицином, аланином и лизином, но беден пролином. Отличительной особенностью эластина является наличие в его структуре поперечных связей необычного характера. Альдегидные группы, возникшие в результате окисления аминогрупп боковых цепей остатков лизина и оксилизина, взаимодействуют с аминогруппой лизина при помощи реакций альдольной конденсации, дегидратации и окисления, образуя десмозин и изодесмозин. Все четыре аминогруппы и карбоксильные группы участвуют в образовании пептидных связей.
Мясо, содержащее много соединительной ткани, остается жестким и после тепловой обработки; усвояемость коллагена и эластина в нем очень низкая. Однако при необходимости усиления двигательной функции кишечника целесообразно использование продуктов, богатых соединительной тканью. В диетах щадящего режима применяют желатин - продукт неполного гидролиза коллагена. По аминокислотному составу желатин неполноценен, но желеобразные продукты из него перевариваются без напряжения секреции пищеварительных органов.
Молоко - это гетерогенная система, в которой в качестве дисперсной фазы выступают эмульгированные жировые глобулы и коллоидные мицеллы казеина, а в роли дисперсионной среды - раствор белков, лактозы, солей и витаминов. Общее содержание белков в молоке колеблется от 2,9 до 3,5%. Среди них выделяются две основные группы: казенны и сывороточные белки (табл. 2.12).
Таблица 2.12. Состав и молекулярные характеристики белковых компонентов молока
| Компоненты | Содержание | Молекулярная масса, кД | ИЭТ | |
| в % от общих белков | в г/л | |||
| Казеин: | 78-85 | ... | ||
| αs1-казеин | } 43-54 | 12-15 | 23,0 | 4,4-4,8 |
| αs2-казеин | 3-4 | 25,0 | - | |
| β-казеин | 25-35 | 9-11 | 24,0 | 4,8-5,1 |
| χ-казеин | 8-15 | 2-4 | 19,0 | 5,4-5,8 |
| Белки сыворотки: | 15-25 | 6-8 | ||
| β-лактоглобулин | 7-12 | 3,6 | 18,3 | 5,1 |
| α-лактальбумин | 2-5 | 1,7 | 14,2 | 4,2-4,5 |
| иммуноглобулины | 1,5-2,5 | 0,6 | 150-1000 | 5,5-8,3 |
| альбумин сыворотки крови | 0,7-1,3 | 0,4 | 69,0 | 4,7-4,9 |
В молоке содержится более 20 ферментов (ксантиноксидаза, пероксидаза, каталаза, липаза, холинэстераза, α-амилаза, лизоцим, протеаза и др.), а также гормоны (пролактин, окси-тоцин, кортикостероиды, тироксин, трииодтиронин и др.) и белки в составе оболочек жировых шариков.
Основными белками молока являются казенны, которые легко перевариваются и являются источниками незаменимых аминокислот, кальция, фосфора и ряда физиологически активных пептидов. Так, при действии в желудке на k-казеин химозина высвобождаются глико- и фосфопептиды, которые регулируют секрецию желудочного сока, моделируют физико-химические свойства белков (растворимость, вязкость, заряд, денатурацию), осуществляют защиту от про-теолиза и влияют на проницаемость мембран клеток. Важнейшими физиологическими функциями обладают и сывороточные белки. Иммуноглобулины выполняют защитную функцию, лактоферрин и лизоцим (фермент) являются носителями антибактериальных свойств, а лактоферрин и β-лактоглобулин выполняют транспортную роль, перенося в кишечник микро- и макроэлементы, витамины и липиды. α-Лактальбумин необходим для синтеза лактозы в молоке из УДФ-галактозы и глюкозы.
Для большинства компонентов казеина, α-лактальбумина, β-лактоглобулина и компонентов протеозо-пептонной фракции расшифрованы первичные и некоторые фрагменты вторичной, третичной и четвертичной структуры. Так, молекулы казеина имеют небольшое количество α-спиралей - 1-6% (тогда как, например, а-лактальбумин состоит из 26% α-спирали, β-конформации) и только остальное количество белка представляет собой неупорядоченную структурную организацию. При образовании четвертичной структуры казеина большая роль отводится гидрофобным взаимодействиям и фосфат-кальциевым мостикам и меньшая - электростатическим и водородным связям. Фосфаткальциевые мостики являются основой казеинаткальциевого фосфатного комплекса, в виде которого и содержится казеин в молоке:

Кальций в составе комплекса выполняет роль структурообразовате-ля, создавая мостик между серинфосфатными группами двух молекул казеина, а остатки фосфорной кислоты усиливают кислые свойства белка, обусловленные присутствием в полипептидах β- и γ-арбоксильных групп аспараги новой и глутаминовой кислот. Казеин из молока осаждается при рН 4,6-4,7, когда на его молекулах наступает равенство положительных и отрицательных зарядов. Осажденный казеин практически не растворяется в воде, но растворяется в слабощелочной среде и растворах солей щелочных металлов и минеральных кислот. Нерастворимый казеин обладает способностью связывать воду в достаточно больших количествах (более 2 г на 1 г белка), что очень важно для устойчивости частиц белка в сыром, пастеризованном или стерилизованном молоке. Гидрофильные свойства казеина усиливаются при взаимодействии его с р-лактоглобулином, которое наблюдается в процессе тепловой обработки молока, и от них зависят структурно-механические свойства сгустков, образующихся при кислотном свертывании или получении сырной массы при созревании сыров.
Промышленные казенны получают из обезжиренного молока действием кислот, кисломолочной сыворотки, введением солей кальция, химозина или других ферментов. В зависимости от способа получения различают казеинат натрия, казеинат кальция, кислотный, сычужный казеин и копреципитат с разными функциональными свойствами. Для регулирования последних часто используют неполный ферментативный гидролиз или смешение с растительными белками и их совместную сушку. При производстве новых форм белковой пищи (аналогов мясных и рыбных продуктов) большое значение имеет гелеобразование казеина, его взаимодействие с веществами небелковой природы, образование стойких эмульсий и явление синерезиса.
Белки молока характеризуются высокой биологической ценностью, они содержат в избыточных количествах лизин и триптофан с одновременным недостатком серосодержащих аминокислот (см. Пищевая и биологическая ценность белков). Белки сыворотки содержат незаменимые аминокислоты в значительно больших количествах, чем казеин, включая лизин, треонин, триптофан, метионин и цистеин.
На долю сывороточных белков от общего количества белков в молоке приходится 0,5-0,8%. β-Лактоглобулин устойчив в кислой среде желудка к действию пепсина, поэтому расщепляется только в кишечнике трипсином и химотрипсином. В процессе пастеризации молока белок денатурируется, образуя комплексы с к-казеином, и осаждается вместе с ним при кислотной и сычужной коагуляции. Податливость данного комплекса действию сычужного фермента понижается. α-Лактальбумин не осаждается в изоэлектрической точке (рН 4,6), не свертывается под действием сычужного фермента и термостабилен в силу большого количества дисульфидных связей. Иммуноглобулины по химической природе являются гликопротеидами. Они выполняют свою функцию, вызывая агглютинацию микроорганизмов и других чужеродных клеток. Выделены три основные группы иммуноглобулинов: G, А и М. Среди них имеются мономеры и полимеры, состоящие из тяжелых и легких полипептидных цепей с молекулярной массой 50 кД и 25 кД, соответственно.
Различают два основных типа молочной сыворотки: сладкую, образующуюся при производстве сыров, и кислую, получаемую при осаждении творога и казеинов. Для применения молочной сыворотки в качестве добавок в хлебопекарной, кондитерской промышленности, для производства смесей для детского питания ее концентрируют методами сушки, ультрафильтрации, электродиализом и осаждением белка в виде комплексов с полиэлектролитами. Для получения изолятов, концентратов и копреципитатов применяют термоденатурацию с последующим осаждением белка в ИЭТ (рН 4,5-4,6) и комплексообразование с анионными полисахаридами (КМЦ, альги-наты и пектины). Эти способы позволяют выделять до 70-90% полноценного белка молочной сыворотки и варьировать его функциональные свойства.






