До середины XX в. считалось, что пептиды не являются самостоятельным классом органических соединений, а представляют собой продукты неполного гидролиза белков, которые образуются в ходе переваривания пищи, в технологическом процессе или при хранении пищевых продуктов. И только после того как В. Дю Виньо (1953) определил последовательность остатков аминокислот двух гормонов задней доли гипофиза - окситоцина и вазопрессина - и воспроизвел их синтез химическим путем, появилась новая точка зрения на физиологическую роль и значение данной группы соединений. Сегодня обнаружено большое количество пептидов, которые обладают индивидуальной последовательностью аминокислот и даже не встречаются в гидролизатах природных белков.
Пептиды имеют невысокую молекулярную массу, широкий набор аминокислотных остатков (в их состав входят, например, D-аминокис-лоты) и структурные особенности (циклические, разветвленные). Названия пептидов образуются из названий аминокислотных остатков путем последовательного их перечисления, начиная с КН2-концевого остатка, с добавлением суффикса -ил, кроме С-концевой аминокислоты, название которой остается без изменений. Например:
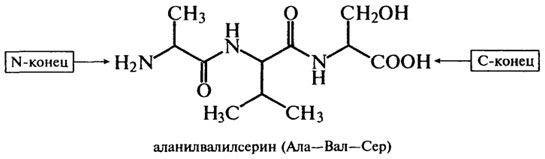
В природе существует два вида пептидов, один из которых синтезируется и выполняет физиологическую роль в процессе жизнедеятельности организма, другой образуется за счет химического или ферментативного гидролиза белков в организме или вне его. Пептиды, образующиеся в процессе гидролиза вне организма (in vitro), широко используются для анализа аминокислотной последовательности белков. С помощью пептидов расшифрована аминокислотная последовательность фермента лизоцима, гормона поджелудочной железы инсулина (Сэнджер), нейротоксина яда кобры (Ю. Овчинников и др.), аспартатаминотрансферазы (А. Браунштейн и др.), пепсиногена и пепсина (В. Степанов и др.), лактогенного гормона быка (Н. Юдаев) и других биологически активных соединений организма.
Ферментативное образование пептидов происходит в желудочно-кишечном тракте человека в процессе переваривания белков пищи. Оно начинается в желудке под действием пепсина, гастриксина и заканчивается в кишечнике при участии трипсина, химотрипсина, амино- и карбоксипептидаз. Распад коротких пептидов завершается ди- и трипепти-дазами с образованием свободных аминокислот, которые расходуются на синтез белков и других активных соединений. Гидролиз белка в желудочно-кишечном тракте обеспечивает структуру радикалов концевых аминокислот, зависящую от места приложения фермента (свойство специфичности). Так, при разрыве белка пепсином пептиды в качестве N-кон-цевых аминокислот содержат фенилаланин и тирозин, а в качестве С-концевых - глутаминовую кислоту, метионин, цистин и глицин. Пептиды, образующиеся из белка при участии трипсина, в качестве С-конце-вых аминокислот содержат аргинин и лизин, а при действии химотрипсина - ароматические аминокислоты и метионин.
Для многих природных пептидов установлена структура, разработаны методы синтеза и установлена их роль. На рис. 2.8 отображены физиологическое значение и функциональная роль наиболее распространенных групп пептидов, от которых зависят здоровье человека и органолептические и санитарно-гигиенические свойства пищевых продуктов.

Рис. 2.8. Важнейшие группы пептидов
Пептиды-буферы. В мышцах различных животных и человека обнаружены дипептиды - карнозин и ансерин, выполняющие буферные функции за счет входящего в их состав имидазольного кольца гисти-дина. Отличительной особенностью пептидов является присутствие в них остатка р-аланина:
H2N-р-аланил-L-гистидин-СООН
карнозин
β-аланил-N-метил-L-гистидин.
ансерин
Синтез дипептидов-буферов осуществляется по схеме без участия рибосом:
β-аланин + АТФ + фермент ↔ фермент-β-аланиладенилат + дифосфат;
фермент-β-аланиладенилат + L-гистидин -" → β-аланил-L-гистидин + АМФ + фермент.
Карнозин и ансерин являются составной частью экстрактивных веществ мяса. Содержание их в последнем достигает 0,2-0,3% от сырой массы продукта.
Пептиды-гормоны. Гормоны - вещества органической природы, вырабатываемые клетками желез внутренней секреции и поступающие в кровь для регуляции деятельности отдельных органов и организма в целом. Гормоны окситоцин и вазопрессин выделяются задней долей гипофиза (придаток мозга). Они содержат по 9 аминокислотных остатков, одну дисульфидную связь и на С-конце - амидную группу -CONH2:
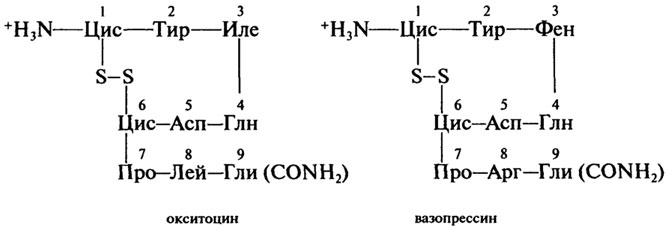
Регуляторная функция обоих гормонов заключается в стимуляции сокращения гладкой мускулатуры организма и секреции молока молочными железами. Различия в природе остатков аминокислот в положении 3 и 8 дополнительно наделяют вазопрессин способностью регулировать водный баланс, осмотическое давление в крови и стимулировать процессы запоминания.
Гормоны гипоталамуса, в котором эндокринный аппарат взаимодействует с высшими отделами ЦНС, являются низкомолекулярными пептидами. Так, тиролиберин представлен трипептидом, состоящим из пироглутаминовой (циклической) кислоты, гистидина и пролинамида (Пи-роглу - Гис - Про - NH2), люлиберин является декапептидом (Пиро-глу - Гис - Три - Сер - Тир - Гли - Лей - Apr - Про - Гли - NH2), а соматостатин - циклическим тетрадекапептидом:

Гипоталамические гормоны участвуют в процессе высвобождения гормонов передней доли гипофиза. Тиролиберин, например, контролирует освобождение тиротропина - гормона, принимающего участие в регуляции деятельности щитовидной железы, соматостатин регулирует активность гормона роста (соматропина), а люлиберин участвует в регуляции выделения лютропина - гормона, влияющего на деятельность половых органов. Многие из гормонов (окситоцин, тиролиберин, пролактин - гормон передней доли гипофиза и гонадолиберин - гормон гипоталамуса) присутствуют в молоке жвачных животных и кормящих матерей.
Известен пептидный гормон меланотропин (МСГ), выделяемый в кровь промежуточной долей гипофиза. Одноцепочный пептид стимулирует образование пигмента, обуславливающего цвет глаз, кожи, волос. Различают две разновидности МСГ: α-МСГ, состоящий из 13 остатков аминокислот, и β-МСГ, в состав которого у человека входит 22 аминокислотных остатка. Панкреатический глюкагон, выделенный в 1948 г. в кристаллическом состоянии из поджелудочной железы человека, состоит из 29 остатков аминокислот. Он обладает двойным действием: ускоряет распад гликогена (гликогенолиз) и ингибирует синтез его из УДФ-глюкозы. Гормон активирует липазу, стимулируя процесс образования жирных кислот в печени.
Нейропептиды. В последние годы в отдельную группу выделяют более 50 пептидов, содержащихся в мозге человека и животных. Эти вещества определяют реакции поведения (боязнь, страх), влияют на процессы запоминания, обучения, регулируют сон, снимают боль. Нейропептиды, называемые эндорфинами и энкефалинами, являются производными β-липотропного гормона гипофиза, состоящего из 91 остатка аминокислот. β-Эндорфин представляет фрагмент гормона с 61-го по 91-й, у-эндорфин - с 61-го по 77-й, а а-эндорфин - с 61-го по 76-й остаток аминокислот. Энкефалины являются пентапептидами следующего строения:
| Тир - Гли - Гли - Фен - Мет | Тир - Гли - Гли - Фен - Лей |
| метионинэнкефалин | лейцинэнкефалин |
Во всем мире сегодня интенсивно проводятся работы по выделению и изучению нейропептидов, целью которых является получение искусственным путем биологически активных соединений для использования их в качестве лекарств.
Вазоактивные пептиды. К группе пептидов, оказывающих влияние на тонус сосудов (вазоактивные), относятся брадикинин, кал-лидин и ангиотензин. Первый пептид содержит 9 остатков аминокислот, второй - 10, а третий - 8. Все они синтезируются из неактивных белковых предшественников в результате процесса постгрансляционной модификации. Например, ангиотензин, обладающий сосудосуживающими свойствами, образуется из белка сыворотки ангиотензиногена при последовательном действии протеолитических ферментов:

Пептидные токсины. Пептидную природу имеет ряд токсинов, вырабатываемых микроорганизмами, ядовитыми грибами, пчелами, змеями, морскими моллюсками и скорпионами. Идентифицировано 5 энтеротоксинов, продуцируемых бактериями Staphylococcus aureus (А, В, С, D и Е) и 7 нейротоксинов (от А до G), вырабатываемых Clostridium botulinum.
Стафилококковые токсины, имея в своем составе 239-296 остатков аминокислот, отличаются по значению изоэлектрической точки, коэффициентам диффузии и седиментации. Токсины могут стать причиной пищевого отравления при употреблении молочных, мясных, рыбных, жидких яичных продуктов, а также салатов и кремовых начинок мучных кондитерских изделий при условии несоблюдения правил санитарно-гигиенической обработки и хранения последних. Ботулинические токсины относятся к наиболее сильнодействующим ядам и часто вызывают смертельные пищевые отравления при использовании овощей, рыбы, фруктов и приправ, не обработанных в соответствии с нормами. Молекулярная масса, например, токсина Е - 350 кД, токсина А - несколько больше. Эти токсины инактивируются при температуре выше 80°С и в кислой среде.
Энтеротоксины могут вырабатываться и бактериями Salmonella и Clostridium perfringens, являясь при этом причиной расстройства работы кишечника, обморочных состояний и лихорадки (брюшного тифа). Продуцируются энтеротоксины чаще в продуктах животного происхождения (говядина, птица, сыр, рыба), чем растительного (фасоль, оливы). Наиболее хорошо изучен энтеротоксин С. perfringens с молекулярной массой 36 кД и изоэлектрической точкой 4,3. Токсин содержит 19 остатков аминокислот, среди которых преобладают аспарагиновая кислота, лейцин и глутаминовая кислота. Ухудшая транспорт электролитов и глюкозы, данный токсин вызывает гибель клеток кишечника.
Ядовитый гриб бледная поганка содержит около 10 циклических пептидов с молекулярной массой около 1000. Типичным представителем их является особо ядовитый токсин а-аманитин. К токсичным компонентам яда пчел, оказывающим сильное влияние на ЦНС, относится апамин, состоящий из 18 аминокислотных остатков, а морских моллюсков - конотоксин, содержащий 13 остатков:

Пептиды- антибиотики. Представителями данной группы пептидов являются грамицидин S - циклический антибиотик, синтезируемый бактериями Bacillus brevis, и сурфактин - поверхностно-активный (содержащий сложноэфирную связь) антибиотик, синтезируемый бактериями Bacillus subtilius. Оба антибиотика эффективны при борьбе с инфекционными заболеваниями, вызываемыми стрептококками и пневмококками:

Грамицидин способен быть ионофором, то есть переносчиком ионов К+и Na+ через мембраны клеток.
Структурной основой антибиотиков, выделяемых плесневыми грибами Penicillium, является дипептид, построенный из остатков D-валина и цистина:

Антибиотики группы пенициллина эффективны при борьбе с инфекциями, вызываемыми стафилококками, стрептококками и другими микроорганизмами.
Вкусовые пептиды. Наиболее важными соединениями этой группы являются сладкие и горькие пептиды. В производстве мороженого, кремов в качестве подсластителей или усилителей вкуса используется аспартам, представляющий собой метиловый эфир L-α-аспартил-L-фенилаланина:

Аспартам слаще сахарозы в 180 раз, однако при длительном хранении и тепловой обработке сладость уменьшается. Подсластитель противопоказан больным фенилкетонурией. Пептиды горького вкуса образуются при распаде белков в сырах и молоке при участии протеаз молочнокислых бактерий. Они представляют собой низкомолекулярные гидрофобные соединения, содержащие от 2 до 8 остатков аминокислот полипептидных цепей αs-казеина и β-казеина. Многие из горьких пептидов содержат N-концевую циклизованную глутаминовую кислоту. По мере гидролиза пептидов горький вкус таких соединений обычно исчезает.
Протекторные пептиды. Одним из наиболее распространенных соединений с протекторными свойствами является трипептид глутатион (γ-глутамилцистеинилглицин). Глутатион содержится во всех животных, растениях, бактериях, однако наибольшее его количество встречается в дрожжах и зародыше пшеницы. Вступая в окислительно-восстановительные реакции, глутатион выполняет функцию протектора, предохраняющего свободные -SH группы от окисления.

Он принимает на себя действие окислителя, "защищая" тем самым белки или, например, аскорбиновую кислоту. При окислении глутатио-на образуется межмолекулярная дисульфидная связь:
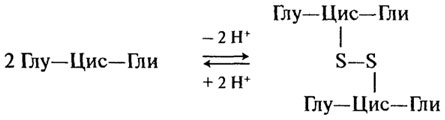
Глутатион принимает участие в транспорте аминокислот через мембраны клеток, обезвреживает соединения ртути, ароматические углеводороды, перекисные соединения, предотвращает заболевание костного мозга и развитие катаракты глаз.
Восстановленная форма глутатиона, входящая в состав хлебопекарных дрожжей, особенно долго хранившихся, или муки из проросшего зерна, понижает упругие свойства клейковины и ухудшает качество пшеничного хлеба. Дезагрегирующее действие восстановленного глутатиона на белки клейковины может осуществляться как без разрыва пептидных связей, так и с их разрывом. Дезагрегация белков без разрыва пептидных связей происходит при участии НДДФН2-содержащего фермента глута-тионредуктазы: Г-S-S-Г + НАД2Ф ↔ 2Г-SH + HАДФ,
а с разрывом - в присудствии тиоловых простериаз, активный центр которых содержит сульфгидрильные группы:
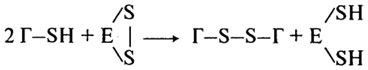
Разрыв пептидных связей в белках под действием активированных протеиназ приводит к ухудшению реологических свойств теста и качества хлеба в целом.
Пептиды, имеющие достаточно высокую молекулярную массу (более 5000 Да) и выполняющие ту или иную биологическую функцию, называются белками. Под первичной структурой белков понимают последовательность аминокислот в полипептидной цепи и положение дисульфидных связей, если они имеются. Последовательность аминокислотных остатков в цепи реализуется за счет пептидной связи. Пептидная связь имеет частично двойной характер, так как расстояние между -NH и -СО группами в ней занимает промежуточное (1,32А) положение между расстояниями одинарной (1,49А) и двойной (1,27А) связей. Кроме того, группы R чередуются по обе стороны пептидной связи, следовательно, наблюдается трансизомерия. Расстояния между другими атомами и углы в структуре полипептидных цепей представлены на рис. 2.9.
Многие белки состоят из нескольких полипептидных цепей, соединенных между собой ди-сульфидными связями. Образование дисульфид-ных мостиков -S-S- возможно и между двумя остатками цистеина, находящимися в одной полипептидной цепи. Примером могут служить основные белковые фракции клейковины: глиадин и глютенин пшеницы (см. Белки злаков).
Определение последовательности аминокислот в белках представляет интерес по двум причинам. Во-первых, эти данные необходимы для выяснения молекулярной основы биологической активности и, во-вторых, для установления тех принципов, на основе которых формируются те пространственные структуры, от которых зависят физико-химические, питательные и функциональные свойства белков, определяющие их усвояемость, переваривание, качество пищевых продуктов, поведение в ходе технологических потоков и хранения.

Рис. 2.9. Расстояние и углы между атомами в структуре полипептидной цепи
Для определения первичной структуры белка сначала разрывают дисульфидные связи, затем определяют аминокислотный состав, N-кон-цевую и С-концевую аминокислоты и порядок соединения аминокислот друг с другом. Разрыв дисульфидных -S-S- связей осуществляют сильным окислителем (надмуравьиной кислотой) или восстановителем, а аминокислотный состав определяют после гидролиза пептидных связей 6 н раствором НС1 при 110°С в течение 24 ч в вакууме. Для анализа триптофана проводят щелочной гидролиз, так как в кислой среде данная аминокислота разрушается. Смеси аминокислот, полученные в результате гидролиза, фракционируют хроматографией на катионообменной смоле и идентифицируют (см. Качественное и количественное определение белка).
Порядок соединения аминокислотных остатков друг с другом определяют химическими (метод Эдмана) и ферментативными методами. Ферментативные методы основаны на свойстве специфичности ферментов. Так, трипсин разрывает молекулу на уровне карбоксильных групп лизина и аргинина, химотрипсин - карбоксильных групп ароматических аминокислот:

Для анализа последовательности аминокислотных остатков исходный материал делят на три части, одну из которых обрабатывают холодной НС1, другую - трипсином, третью - химотрипсином. Полученные смеси пептидов анализируют по аминокислотному составу и обрабатывают, наконец, экзопептидазами (амино- и карбоксипептидазами). Результаты суммируют с учетом того, что разрыв пептидов происходит в определенных местах цепи. Ниже иллюстрируется аминокислотная последовательность пептида из 25 первых аминокислот α2- и γ1,-глиадинов пшеницы, расшифрованная таким образом для американского сорта Понка:

Полипептидная цепь белковой молекулы не лежит в одной плоскости. Полинг и Кори показали, что многие белки имеют конфигурацию α-спирали, которую легко можно представить в виде спирали, идущей по поверхности воображаемого цилиндра.
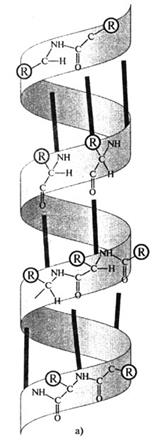
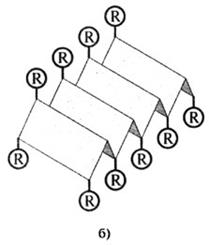
Рис. 2.10. Вторичная структура белков:
а) α-спираль (жирные линии - водородные связи);
б) β-конформация (R - боковые группы аминокислотных остатков)
Такая структура устойчива благодаря большому количеству водородных связей между -СО и -NH группами пептидных связей. Водородные связи возникают между ковалентно связанным атомом водорода, несущим небольшой положительный заряд, и соседним атомом, обладающим незначительным отрицательным зарядом (кислородом, азотом). Некоторые фибриллярные белки ф-керотин, фиброин шелка) образуют (3-конформацию, представляющую как бы ряд листков, расположенных под углом друг к другу (рис. 2.10).
Наряду с большим количеством водородных связей в стабилизации вторичной структуры белка принимают участие другие относительно слабые связи: электростатические и гидрофобные. Энергия этих связей мала по сравнению с энергией ковалентных пептидных и ди-сульфидных связей, однако благодаря своей многочисленности они обеспечивают устойчивость макромолекул и позволяют образовывать активные комплексы (фермент-субстрат, антиген-антитело, репрессор-ДНК). Природа таких связей приведена на рис. 2.11.
Между двумя противоположно заряженными полярными группами, например, боковыми цепями аспарагиновой и глутаминовой кислот и положительно заряженным протони-рованным основанием (остатки аргинина, лизина, гистидина), осуществляются электростатические притяжения. Они более прочные, чем водородные связи. Гидрофобные связи возникают при участии групп -СН2, - СН3 ва-лина, лейцина или ароматического кольца фенил-аланина. Они представляют собой скопление заряда, обусловленного выталкиванием воды из пространства при близком взаимном расположении неполярных групп.
Регулярную вторичную структуру пептидных связей обеспечивают водородные связи, тогда как другие слабые силы участвуют в ней в меньшей степени. Слабые силы имеют большее значение в формировании третичной структуры белка.

Рис. 2.11. Слабые связи:
Водородные: 1 - между пептидными группами; 2 - между кислотами и спиртами (серии); 3 - между фенолом и имидазолом.
Электростатические: 4 - между основаниями (аргинин, лизин) и кислотами (глутаминовая, аспарагиновая).
Гидрофобные: 5 - при участии лейцина, изолейцина, валина, аланина; 6 - с участием фенилаланина
Впервые третичная структура установлена для миоглобина, затем для гемоглобина крови. В данной структуре белка важную роль играют изгибы, обусловленные присутствием аминокислоты пролин. В изгибах отсутствует спирализованная структура. Общим признаком пространственного расположения остатков аминокислот в третичной структуре белков является локализация гидрофобных групп внутри молекулы, гидрофильных - на ее поверхности.
Многие белки обладают четвертичной структурой. Она представляет собой комбинацию субъединиц с одинаковой или разной первичной, вторичной и третичной структурой. Субъединицы соединены друг с другом с помощью слабых нековалентных связей. Действия мочевины, кислых и солевых растворов, детергентов часто приводят к диссоциации белка на субъединицы и потере их биологической активности. Диссоциация может быть обратимой. Примером белков с четвертичной структурой могут служить ферменты лактатдегидрогеназа и глютаматдегидрогеназа, содержащие, соответственно, четыре и восемь субъединиц.
Особенности химического строения боковых цепей аминокислотных остатков и расположение их в пространстве определенным образом обеспечивают, при выполнении белками биологических функций, компле-ментарность (соответствие) контактируемых поверхностей или поверхностей белка с небелковыми соединениями по принципу "ключ к замку". Имеется ряд экспериментальных доказательств относительно механизма формирования структуры молекулы белка путем ассоциации α-спиралей и складчатых β-слоев (рис. 2.12). Этапы скручивания белка включают формирование двух временно создающихся коротких α- или β-спиралей, которые затем стабилизируются с образованием комплекса. Сформировавшиеся комплексы αα, β, αβ, называемые единицами скручивания, далее выступают в роли самостоятельных центров, способных к взаимодействию с другими элементами вторичной структуры. Задача заключается в том, чтобы как можно полнее расшифровать тот путь, который приводит к формированию функционально активной структуры белка в каждом конкретном случае.

Рис. 2.12. Предполагаемые этапы скручивания белка






